 Allgemeine und Anorganische Chemie (AC1)
Allgemeine und Anorganische Chemie (AC1) Liegt ein Ion vor, so wird dessen Ladung gleich zu Beginn der Betrachtung berücksichtigt. Beispiele sind die von ClF3 abgeleiteten Ionen ClF4+ und ClF4−, zuerst ClF4+. Die erste Frage lautet immer: liegt das Zentralelement in der höchsten Oxidationsstufe vor? Wenn nein, so wie hier, weiter:
• Bilde 2e-2z-Bindungen; die Ladung des gesamten Ions wird an dieser Stelle berücksichtigt, indem von Cl+ ausgegangen wird.
• Bilde 4e-3z-Bindungen mit den restlichen Substituenten.
• Wenn man möchte: bilde die Lewis-Formel:

Die Analyse ergibt für das ClF4+-Ion einen wippenartigen Aufbau (ein Oktaeder, dem zwei benachbarte Ecken fehlen). Die Strukturanalyse an Kristallen eines ClF4[SbF6] bestätigt die wippenartige Struktur:
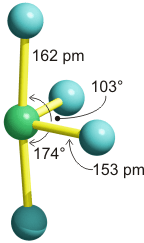
Die Cl-F-Bindungen sind bei den einander gegenüberliegenden F-Atomen im Einklang mit der geringeren kovalenten Bindungsordnung größer, der zugehörige F-Cl-F-Winkel ist nahe bei 180°. Der F-Cl-F-Winkel bei den 2e-2z-Bindungen ist merklich größer als 90° und deutet auf die Vereinfachungen des Modells hin (die gröbste in diesem Fall: dass das Cl(3s)-Orbital von den Bindungen zu den Fluor-Substituenten ausgeschlossen wurde).
Dieselben Schritte führen für das ClF4−-Ion zu einer quadratisch planaren Struktur:

Die kovalente Bindungsordnung aller Cl-F-Bindungen ist hier ½. Auch hier bestätigt die Strukturanalyse die Vorhersage. Als mittlere Bindungslänge wird dabei 179 pm ermittelt, was einer deutlichen Aufweitung gegenüber einer 2e-2z-Bindung zwischen Chlor und Fluor entspricht.