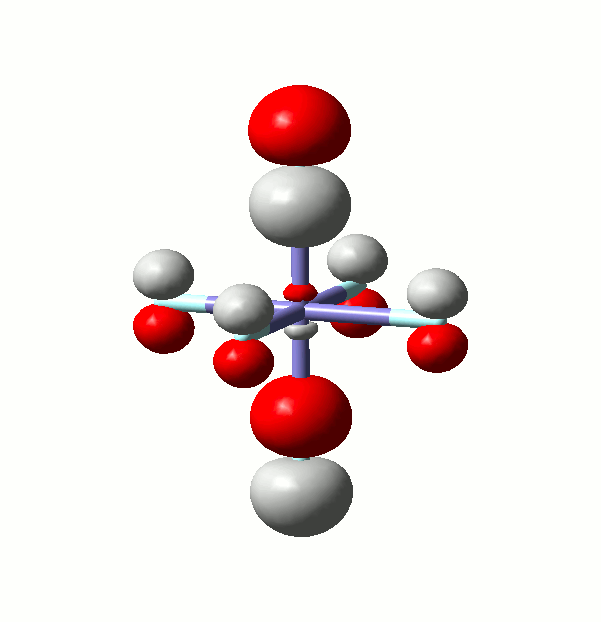
Wenn Sie die im Skript vorgestellten Rechnungen nachvollziehen und/oder weitergehend interpretieren wollen, achten Sie auf einen geläufigen Fallstrick. Er ist am Orbital 29a der Rechnung an Hexafluoridoferrat(III) dargestellt, das eine bindende Wechselwirkung zwischen einem Metall-4p und sechs Ligandbeiträgen darstellt – zwei vom σ- und vier vom π-Typ. Mit isovalue = 0.06 ergibt sich folgendes Bild:

Die im Skript für das α-MO 29 als bindend eingestufte Metall-Ligand-Wechselwirkung sieht jedoch deutlich antibindend aus. Vergleichen Sie nun mit einem Bild bei isovalue = 0.01. Da man in raumfüllender Darstellung vom Zentralatom nichts mehr sieht, ist nun ein Schnitt durch die yz-Ebene gezeigt. Die x-Achse, die oben ungefähr auf den Betrachter zuwies, ist nun genau auf Sie gerichtet:
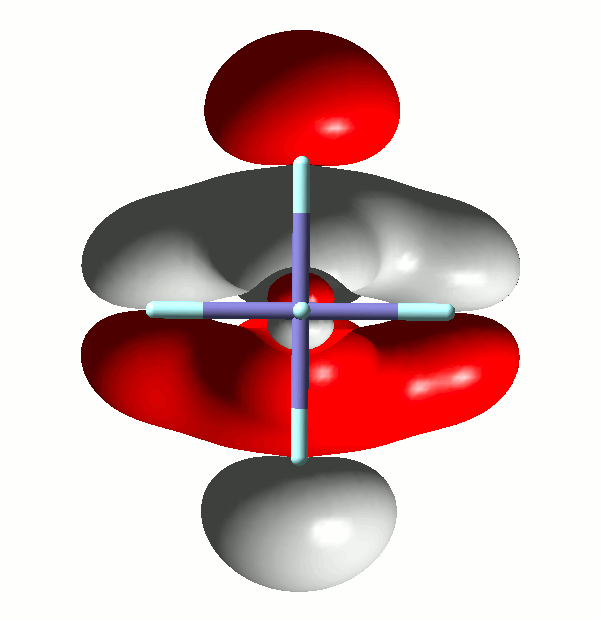
Vergleichen Sie nun mit den Abbildungen von s- und p-Orbitalen höherer Schalen, wie Sie sie in den Lehrbüchern finden können: Es gibt Knotenebenen im Inneren eines Atomorbitals! Ein Beispiel ist ein p-Orbital aus der Valenzschale eines Kryptonatoms, also wie beim Eisenkomplex ein 4p-Orbital (isovalue = 0.02):
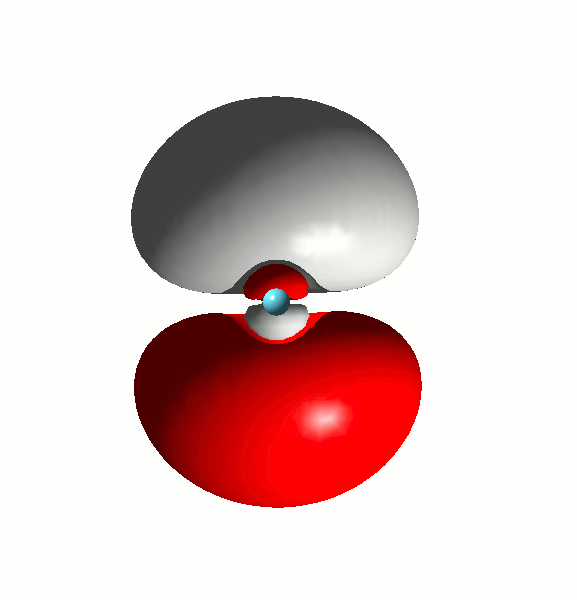
Die Folge: das obere Bild zeigte keine Knotenfläche zwischen den Atomorbitalen des Metalls und der Liganden, also keine Antibindung, sondern eine innere Knotenfläche im Metall-4p-Orbital, während der diffuse äußere Teil in der Überlappung mit den Ligand-AOs aufgeht.