 Koordinationschemie (AC3)
Koordinationschemie (AC3) Koordinationschemie (AC3)
Koordinationschemie (AC3)Die Vorlesung wird im SS2022 vom Kollegen Böttcher gehalten. Informieren Sie sich bitte bei ihm wegen aller Einzelheiten.
a) Bachelorstudiengang Chemie und Biochemie: Studierende im 4. Semester.
b) Lehramtstudium Chemie: Studierende im 6. Semester.
Die Vorlesung vermittelt die Grundlagen der Koordinationschemie und bereitet im Bachelor/Master-Studium auf Vorlesungen in Bioanorganischer Chemie und Organometallchemie vor. Für Lehramtsstudierende ist die Vorlesung Vorbereitung zum Forschungspraktikum. Die Vorbildung von Bachelor- und Lehramtsstudierenden ist in Bezug auf diese Vorlesung weitgehend gleichwertig, außer dass die Symmetrielehre im Lehramtscurriculum bisher nicht vorkam. Deswegen gibt es für die Höher aus dem Lehramt eine Doppelstunde, in der die nötigen Informationen zu den geläufigen Punktgruppen und zum Umgang mit Charaktertafeln gegeben werden – zeitlich meist kurz vor dem MO-Schema eines oktaedrischen Komplexes. Zu dieser Doppelstunde gibt es etwas Lehrmaterial.
Sie sollten zur Klausur die Haupt- und Nebengruppen des Periodensystems im Kopf haben; die Lanthanoide und die Actinoide brauchen Sie für diese Vorlesung nicht auswendig zu lernen.
Alte Klausuren:
| SS 2021: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2020: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2019: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2018: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2017: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2016: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2015: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2014: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2013: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2012: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2011: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2010: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2009: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| SS 2008: | Klausur | Lösung |
| SS 2007: | Klausur | Lösung |
| SS 2006: | Klausur | Lösung |
| 2. Klausur | Lösung | |
| 3. Klausur | Lösung |
Hier das Ergebnis der Klausur vom 1. Oktober 2021 (Notenschlüssel.)
In der Vorlesung Koordinationschemie werden die grundlegenden Prinzipien der Komplexchemie behandelt, das Schwergewicht liegt auf den Übergangsmetallen.
Viele einführende Dinge können Sie im Buch Koordinationschemie – Grundlagen und aktuelle Trends von Birgit Weber nachlesen (Springer, 2014, ISBN 978-3-642-41684-2), das Sie mit Ihrem E-Medien-Zugang der UB München auch als pdf herunterladen können (auf den Link klicken, dann Ihr E-Medien-Bookmarklet nachladen, oder über E-Medien zu OPAC, Buch suchen und herunterladen).
Prüfen Sie hier, ob Ihr Browser das Skript korrekt darstellt.
Computerchemische Rechnungen sind in der Regel mit Orca ausgeführt. Werden Koordinationsverbindungen oder -ionen berechnet, die in der Realität in wässriger Lösung vorliegen, wird das in Orca implementierte CPCM-Modell mit Standardparametern genutzt, des Weiteren werden van-der-Waals-Wechselwirkungen durch Grimmes Verfahren berücksichtigt. Paramagnetische Komplexe werden in DFT-Rechnungen „unrestricted“ gerechnet (α- und β-Spins mit unterschiedlicher Energie). Bei den einzelnen Abbildungen sind in üblicher Notation Methode und Basissatz angegeben; bp/def2-tzvp steht zum Beispiel für das reine (nicht Hybrid-) Dichtefunktional BP86, def2-tzvp ist einer der Ahlrichs-Basissätze. Eine typische Eingabedatei für Orca, mit der eine Strukturoptimierung am Hexaammineisen(II)-Ion angestoßen wird, können Sie zum Nachrechnen verwenden (Einzelheiten der Rechnung: 1. Zeile: uks [unrestricted Kohn-Sham], bp [BP86-Methode], ri [technisches Detail], d3 [Grimmes van-der-Waals-Korrektur], def2-tzvp [Basissatz], def2/j [Hilfsbasissatz für ri], tightscf [technisches Detail], opt [Strukturoptimierung, Computerchemiker sagen dazu „Geometrieoptimierung“], cpcm(water) [Aufbau einer wasserartigen Umgebung]. Die nächsten vier Zeilen sorgen für die Übernahme aller nötigen Information in die Ausgabedatei, um Orbitale ansehen zu können. Mit „* xyz 2 5“ beginnt die Eingabe des Moleküls: xyz sagt kartesische Koordinaten an, 2 ist die Ladung, 5 die Multiplizität).
Als graphisches Werkzeug zur Bedienung von Orca ist Gabedit empfehlenswert, mit dem die Abbildungen zu den Orca-Rechnungen angefertigt wurden; auch sehr schön: Avogadro.
Komplexverbindungen sind Lewis-Säure-Base-Addukte – mit deutlichen Auswirkungen auf die Lewis-Base. Wassermoleküle als Liganden zeigen dieses Prinzip, das die Grundlage der Metallkatalyse ist, besonders deutlich.
Was ist der Unterschied zwischen einer Atombindung und einer dativen (koordinativen) Bindung? Wie weit geht die Ähnlichkeit zwischen isosteren Molekülen wie Ethan, H3C–CH3, und Amminboran, dem Ammoniak-Addukt an Boran, H3N→BH3 bzw. H3N+–B−H3? Dative Bindungen und „normale“ Bindungen (Atombindungen und Ionenbindungen) unterscheiden sich durch die verschiedene Weise, auf die sie bei Zufuhr der Bindungsdissoziationsenergie zerfallen. Dative Bindungen werden durch die Bindungsdissoziationsenergie heterolytisch gespalten, normale Bindungen homolytisch (dies gilt auch für Ionenbindungen; die gelbe Flammenfärbung des Natriumchlorids entsteht durch Anregung der 3s-Valenzelektronen von Natriumatomen, die bei der thermischen Spaltung des Salzes entstehen!).
Wir wiederholen eine weitere Einzelheit der Grundvorlesung: ist es in einem Salz wie Na[AlCl4] sinnvoll, eine koordinative Bindung von drei normalen Bindungen zu unterscheiden?
Wird die Lewis-Säure BH3 durch ein Metall-Kation ersetzt, das in Abhängigkeit von seiner Größe und Ladung ebenfalls mehr oder weniger Lewis-acide ist, und das in der Regel mehr als ein Molekül der Lewis-Base bindet, wird eine Koordinationsverbindung erhalten, auch Komplexverbindung, Metallkomplex oder ähnlich genannt. Die Lewis-Säure heißt Zentralatom, die Basen sind die Liganden. Die Bindung eines Liganden an ein Zentralatom ändert die Eigenschaften des Liganden drastisch. Diese Erfahrung bildet die Grundlage der Metallkatalyse: in der Organometallchemie als Grundlage für die technische Katalyse, in der Bioanorganischen Chemie als Grundlage zum Verständnis von Metalloenzymen, die etwa die Hälfte der bekannten Enzyme ausmachen.
Einer der bedeutendsten Liganden ist Wasser, das wegen der beiden freien Elektronenpaare am Sauerstoffatom eine Lewis-Base ist. Eine wichtige Eigenschaft des Wassers, seine Brønsted-Acidität, ist ein Parameter, der durch die Bindung an das Zentralatom stark verändert wird. So wird der pKA-Wert der sehr schwachen Säure Wasser von 15.7 in den Bereich starker Säuren verschoben, wenn ein Wassermolekül als Ligand an eine starke Lewis-Säure bindet. Bei der Deprotonierung dieser sauren Aquakomplexe entsteht metallgebundenes Hydroxid, Hydroxido-Liganden. Hydroxido-Liganden sind oft bessere Liganden gegenüber einem zweiten Metall-Ion als freie Wassermoleküle, so dass Hydroxido-Liganden oft als Brückenliganden gefunden werden.
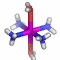
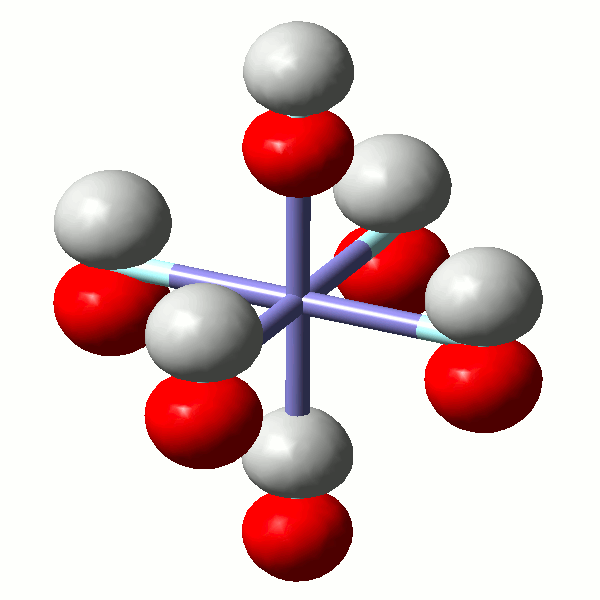
Die Vorgänge bei der Fällung von Aluminiumhydroxid durch allmähliches Alkalisieren einer sauren Aluminium(III)-Salzlösung lassen sich in diesem Sinne betrachten. So zeigen Speziesverteilungs-Diagramme, in denen in einem interessierenden pH-Bereich die jeweils auftretenden Komplexe dargestellt sind, dass durch die vielfache Ausbildung von Hydroxido- und auch Oxido-Brücken mehrkernige Komplexe gebildet werden. Ein Beispiel für eine besonders wichtige Spezies im Neutralbereich ist der dreizehnkernige Aluminiumkomplex [Al13O4(OH)24(H2O)12]7+, der bei weiterer Erhöhung des pH-Wertes bis zu Tetrahydroxido-aluminat abgebaut wird (man beachte die Protonierung von Oxidoliganden zu Hydroxido-Liganden durch Basenzugabe!). Der Aufbau des 13-kernigen Kations ist in Figure 3 von [al_speciation_2006] dargestellt. Beachten Sie auch das gemeinsame Bauprinzip weiterer Hydroxidoaluminium-Cluster. Figure 2 in [al_speciation_2006] zeigt mit der NMR-Spektroskopie einen besonders wichtigen experimentellen Zugang zu dieser Chemie.
Das folgende Bild zeigt ein solches [Al13O4(OH)24(H2O)12]7+-Ion. Da die Lagen der Wasserstoffatome nicht experimentell bestimmt wurde, ergibt sich die Zuordnung von Sauerstoffatomen zu Aqua-, Hydroxido- oder Oxido-Liganden nur aus der Ladungsbilanz (eben so, dass 7+ herauskommt). Die Oxido-Liganden sind die vier Liganden, die in der Mitte des Kations das tetraedrisch umgebene Al-Atom koordinieren. Diese vier Oxido-Liganden sind ebenfalls tetraedrisch von Aluminium-Zentralatomen umgeben – sie sind vierfach verbrückend. Dies kann man auch in der Formel ausdrücken: [Al13(μ4-O)4(μ2-OH)24(H2O)12]7+. Statt μ2 genügt auch ein einfaches μ: [Al13(μ4-O)4(μ-OH)24(H2O)12]7+.
Als Überleitung zum nächsten Kapitel betrachten wir eine Speziesverteilung in einer Aluminiumsalzlösung der Gesamtkonzentration 5 μm. Die Ordinate ist in Prozent eingeteilt, das dreizehnkernige Ion ist violett eingetragen „Al“ ist Aluminium im Standardzustand, also das Aquaaluminium(III)-Ion, H−1 ist ein fehlendes Proton, hier ein Hydroxid-Ion, H−2 könnte dann ein Oxid-Ion sein oder zwei Hydroxid-Ionen; H−32 codiert den O4(OH)24-Teil des 13-kernigen Anions, AlH−3(s) ist festes Aluminiumhydroxid]:
[al_speciation_2006]
W. H. Casey:
Large Aqueous Aluminum Hydroxide Molecules.
Chem. Rev. 2006, 106, 1–16.
doi:
10.1021/cr040095d
Wasser als Ligand heißt „aqua“, Ammoniak „ammin“, Hydroxid „hydroxido“ – es erhält die Endung „o“ wie alle anionischen Liganden (fluorido, chlorido, sulfato, nitrato, …). Die Zahl der Liganden wird meist auf griechisch angegeben (mono, di, tri, tetra, penta, hexa, …) und der Ligandnamen ohne Klammern angehängt; [Al(H2O)6]3+ ist daher das Hexaaquaaluminium-Ion. Besonders, wenn der Ligandname selbst mit einem Zahlwort anfängt oder anfangen könnte, wird anders gezählt (bis, tris, tetrakis, pentakis, …) und der Ligandnamen in Klammern eingeschlossen, damit es keine Verwirrung gibt: So nennt man die Komplexe des Waschmittelzusatzes Triphosphat Triphosphato-Komplexe, während Komplexe mit drei Orthophosphato-Liganden zur Unterscheidung Tris(phosphato)-Komplexe genannt werden. Ist der Komplex ein Anion, wird das Zentralatom neulateinisch bezeichnet und mit der Endung „-at“ versehen: [Al(OH)4]− ist Tetrahydroxidoaluminat.
Die aktuelle (2005) Nomenklatur ist in ausführlicher Form in IUPACs Red Book zusammengefasst. Von diesem Text liegt auch eine Kurzfassung vor.
Vorübung: Wir machen uns die Speziesverteilungskurve für das System NH4+/NH3 klar und wir reden über den Umgang mit Einheiten.
Wird das Massenwirkungsgesetz auf die Bildung eines Komplexes aus dem Zentralmetall in dessen Standardzustand (in der Regel der Aqua-Komplex) und den Liganden angewendet, so werden Beständigkeitskonstanten erhalten. In der Regel muss nur eine Konzentration gemessen werden, um die Konstante zu errechnen, da Massebilanzen gelten. Soll zum Beispiel für eine einfache Komplexbildungsreaktion
M + L ⇄ ML
die Beständigkeitskonstante
| [ML] | = β |
| [M] [L] |
bestimmt werden, so gelten Randbedingungen, die sich aus der Ausgangskonzentration C, der Menge an eingesetztem Metall und Ligand pro Volumen, ergeben, nämlich:
C(M)/mol L−1 = [ML] + [M]
und
C(L)/mol L−1 = [ML] + [L]
(jetzt und im Folgenden sind alle Ladungen weggelassen; H steht also für H+). In solche Massebilanzen bringt ein protonierbarer Ligand – der Regelfall – weitere Gleichungen ein. Mit
| KA = | [H] [L] |
| [HL] |
und der Erweiterung der Gleichung für C(L) zu
C(L)/mol L−1 = [ML] + [L] + [HL]
wird deutlich, dass die einzige zu messende Variable auch [H] sein kann, letztlich also der pH-Wert. Die Titration einer sauren Lösung, die das Metall und die protonierte Form des Liganden enthält, mit Lauge unter pH-Wert-Messung nach jeder Laugezugabe ist daher das Standardverfahren zur Bestimmung von Komplexbildungkonstanten. Es wird also im Prinzip die Konkurrenz zwischen zwei Lewis-Säuren um den Lewis-basischen Ligand betrachtet: auf der einen Seite Protonen, auf der anderen das gerade interessierende Metall.
Beständigkeitskonstanten werden hier ausnahmslos in Form von Bruttobeständigkeitskonstanten (β) angegeben. Für das Tetraammin-kupfer(II)-Ion [Cu(NH3)4]2+ (abgekürzt CuN4) ist diese zum Beispiel definiert als
| β = | [CuN4] |
| [Cu] [N]4 |
Viele weitere Größen können von Beständigkeitskonstanten abgeleitet werden: So können für verschiedene Ausgangskonzentrationen an Ligand und Metall Speziesverteilungskurven aufgestellt werden, so dass in übersichtlicher Form auch komplexe Lösungsgleichgewichte dargestellt werden können, wie sie zum Beispiel im wässrigen System Cu2+/NH3 vorliegen.
Die Abbildung zeigt ein solches Speziesverteilungsdiagramm für eine wässrige Lösung, die eine Gesamtkonzentration von 0.05 mol L−1 Kupfer(II) und 0.5 mol L−1 NH3/NH4+ enthält. Der NH3/NH4+-Überschuss und die Gesamtkonzentration sind hier so groß gewählt, dass um den Neutralpunkt herum kein Kupfer(II)-hydroxid ausfällt. Die Speziesverteilung in einer Lösung, die durch Zugabe von Ammoniak zu Kupfer(II)-Salz in der angegebenen Konzentration erhalten wird, ist am rechten Rand des Diagramms abzulesen (pH ca. 11).
Um das Diagramm zu zeichnen, wurden die folgenden Bruttobeständigkeitskonstanten für die Spezies CuiNj verwendet, außerdem wurde das Ionenprodukt des Wassers mit 10−14 und der pKA-Wert des Ammoniumions mit 9.53 eingesetzt:
| ij | log β |
|---|---|
| 11 | 4.0 |
| 12 | 7.4 |
| 13 | 10.2 |
| 14 | 12.0 |
| 15 | 11.1 |
Auffallend große Beständigkeitskonstanten werden bei Chelatkomplexen bestimmt; diese sind in der Regel um einige Zehnerpotenzen größer als diejenigen verwandter Komplexe mit einzähnigen Liganden (das sind Liganden, bei denen ein Atom eine Bindung zum Metall aufbaut). Dieser Chelateffekt ist im Wesentlichen ein entropischer Effekt, da ein Chelatligand zwei oder mehrere einzähnige Liganden im Lösungsgleichgewicht freisetzt, so dass auf der Seite des Chelatkomplexes die größere Unordnung im System herrscht. In gleicher Weise erklärt sich der makrocyclische Effekt, von dem wir reden, wenn alle Atome eines vielzähnigen Liganden Teil eines Ringes sind. Zwei dieser als Liganden wichtigen Makrozyklen sind [14]aneN4 (auch: cyclam) und [12]aneN4 (auch: cyclen), ein 14- und ein 12-gliedriger Ring aus CH2-Gruppen, in dem jeweils vier CH2-Gruppen durch Stickstoffatome ersetzt sind:
Beim Vergleich der Beständigkeitskonstanten des [CuII(cyclen)]2+-Komplexes (lg β = 23.3) mit dem Komplex [CuII(trien)]2+ (lg β = 20.1) des offenkettigen N4-Liganden trien (Formel weiter unten), der formal dadurch einsteht, dass eine Ethylengruppe aus cyclen entfernt wird, wird klar, dass Entropie nicht nur in der blossen Teilchenzahl stecken kann, sondern auch in der Beweglichkeit eines Moleküls.
Es ist übrigens nicht so einfach, solche großen Ringe mit den Standardmethoden der organischen Chemie aufzubauen. Eine Möglichkeit, die hohe Bildungstendenz von Chelatkomplexen für die Herstellung solcher Makrocyclen zu nutzen, ist die Templatsynthese, mit der sich auch cyclam aufbauen lässt (können Sie eine Methode vorschlagen, cyclam aus einem Komplex der offenkettigen Vorstufe 3,2,3-tet aufzubauen? 3,2,3-tet ist N,N'-Bis(3-aminopropyl)ethan-1,2-diamin).
Das Kapitel schließt mit einem Hinweis auf die Irving-Williams-Reihe und einer Einführung in das HSAB-Konzept, dass ursprünglich aus Komplexbildungskonstanten abgeleitet wurde.
Zum Schluss wird eine kurze Übersicht über mehrzähnige Liganden gegeben. Unter den zweizähnigen Liganden – diese würden bei oktaedrischer Koordination zwei cis-ständige Koordinationsstellen besetzen – sind geläufig: Ethylendiamin (en), 2,2'-Bipyridin (bpy), 1,10-Phenanthrolin (phen), Oxalat (ox), das Anion von Diacetyldioxim = Dimethylglyoxim (dmg), das Anion von Oxin = 8-Hydroxychinolin (hych) und das Anion von Acetylaceton (acac).
Tartrate (als Ligand: tart), die Dianionen der verschiedenen Weinsäure-Isomere (meso-, d-, und l-tart) sind ein Beispiel, wie vielfältig die Bindungsmöglichkeiten eines Liganden sein können. (Zeichnen Sie zur Übung d-, l- und meso-Tartrat.) Die abgebildete Form wird in schwach saurer Lösung bei Tartrat-Überschuss gefunden, wenn die Lewis-Acidität des Zentralmetalls nicht zu hoch ist. Ist sie hoch oder ist die Lösung neutral bis schwach alkalisch, so liegt die koordinierende OH-Gruppe deprotoniert vor. Ist die Lösung stark alkalisch, binden die beiden mittleren O-Atome in deprotonierter Form das Zentralmetall – so liegt Kupfer(II) in Fehlingscher Lösung vor, nämlich als [Cu(l-tartH−2)2]6−. Wird Tartrat nicht im Überschuss zugegeben, können vier O-Atome des dann vierzähnigen Tartrat-Liganden an zwei Metallatome binden (im Bild gestrichelt angedeutet).
Dreizähnige Liganden, die eine Fläche eines Oktaeders überdecken können (faciale Anordnung, in Formeln fac) sind Diethylentriamin (dien), zuverlässiger Hydrido-trispyrazolyl-borat (tpb); solche, die die zweite mögliche Anordnung am Oktaeder – die meridionale (in Formeln: mer – realisieren können, sind dien oder das Dianion der o,o'-Dipicolinsäure (dipic). Man beachte bei dien, dass hier das zweizähnige en um einen Aminoethyl-Rest ergänzt ist.
Ein in Natur und Technik bedeutsamer Ligand ist das Triphosphat-Anion. In technischen Reinigungsmitteln wird es auch heute noch als wirksamer Ligand für Calciumionen verwendet, also zum Maskieren der Härtebildner des Wassers. Der Komplex hat Ähnlichkeit mit einem strukturell aufgeklärten Calciumkomplex, bei dem das Zentral-Ion von zwei Adenosintriphosphat-Liganden koordiniert ist. Im Bild sind die beiden Adenosyl-Reste am Triphosphat des ATP weggelassen (die C5'-Atome an den beiden Riboseresten binden jeweils am äußerst linken abgebildeten O-Atom):
Bekannte vierzähnige Liganden sind Triethylentetramin (trien), Tris(2-aminoethyl)amin (tren) und Nitrilotriacetat (nta). Man beachte die Isomerie zwischen trien und tren. trien entsteht aus dien durch Aminoethylierung eines der beiden äußeren N-Atome, tren durch Anlagerung einer Aminoethylfunktion an das mittlere Stickstoffatom von dien.
Bis zu sechs koordinative Bindungen kann Ethylendiamintetraacetat (edta) ausbilden.
Die oktaedrische Koordination, die mit dem sechszähnigen edta-Liganden möglich ist, sieht so ähnlich aus wie es bei einer Strukturanalyse an Kristallen eines Chrom(III)-Komplexes mit dem homologen Liganden Ethylendiamintriacetatpropionat gefunden wurde (abgebildet ist nur das Chromat-Ion; man beachte den Carboxyethyl- anstelle eines vierten Carboxymethyl-Substituenten):
Die belebte Natur wendet dieselben Prinzipien an, um besonders stabile Komplexe aufzubauen. So aquirieren Bakterien auf aggressive Weise das für ihr Wachstum essentielle Eisen, indem sie den sechszähnigen Liganden Enterobactin freisetzen. Der Eisen(III)-Komplex enthält drei zweizähnige Catecholato-Liganden, die durch einen Triserin-Cyclus räumlich fixiert sind (bis heute ist die Struktur des Eisen(III)-Komplexes nicht durch Kristallstrukturanalyse bestimmt worden; der abgebildete Vanadium(III)-Komplex sollte jedoch den gleichen Aufbau haben):
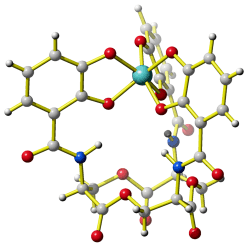
Erkennen Sie im Bild spezielle Wechselwirkungen, die zur Starrheit des Liganden beitragen?
Die hinreichend hohen Beständigkeitskonstanten der Ammin-kupfer(II)-Komplexe führen dazu, dass sich auf Zugabe eines Ammoniaküberschusses diese blauen, löslichen Komplexe bilden und nicht aufgrund der pH-Erhöhung stattdessen Kupfer(II)-hydroxid ausfällt – was mit einer kleinen Ammoniakmenge ja auch zu beobachten ist. Eine wässrig-saure Lösung, in der Hexaaqua-chrom(III)-Ionen, [Cr(H2O)6]3+, vorliegen, verhält sich anders. Eine kleine Menge Ammoniaklösung fällt auch hier das Hydroxid, nämlich Cr(OH)3 – aufgrund derselben Vorgänge wie bei Aluminium (siehe oben). Das Hydroxid ist sehr schwerlöslich, sein Löslichkeitsprodukt beträgt:
L = [Cr3+][OH−]3 = 6.7 × 10−31
Aber auch der Hexaammin-chrom(III)-Komplex ist außerordentlich stabil, so dass die Bildung dieses violetten Komplexes erwartet werden darf. Im Experiment – das auch Teil des Trennungsgangs ist – entsteht jedoch das Hydroxid (die Bildung des zu erwartenden Amminkomplexes wird im Jander-Blasius als Störung abgehandelt!). Dieser Fall, dass etwas aufgrund der thermodynamischen Daten passieren sollte, es aber nicht passiert, ist aus einfachen Experimenten der Grundvorlesung bekannt: Ammoniak sollte zum Beispiel an Luft zu Stickstoff und Wasser verbrennen – was bei Raumtemperatur aber nicht geschieht: das Ammoniak-Luft-Gemisch ist metastabil, das heißt, der betrachtete Vorgang benötigt eine gewisse Aktivierungsenergie, die aber unter den betrachteten Bedingungen nicht zur Verfügung steht. Genau dies liegt beim Chrom-Beispiel vor: Die Gleichgewichteinstellung im Ligandsubstitutions-Gleichgewicht
[Cr(H2O)6]3+ + 6 NH3 ⇄ [Cr(NH3)6]3+ + 6 H2O
ist durch eine ungewöhnlich hohe Aktivierungsbarriere behindert. Im Gegensatz zum wässrigen Cu2+/NH3-System, bei dem für den Ligandaustausch keine Aktivierungsbarriere erkennbar ist – die Kupferkomplexe sind labil –, sind die Chromkomplexe inert. In der Praxis spricht man von inertem Verhalten, wenn die erwartete Reaktion Minuten und länger braucht. Die thermodynamische Aussage (stabil oder unstabil) ist strikt von der kinetischen Aussage (labil oder inert) zu trennen (der Begriff „metastabil“ ist dabei leider nicht sehr hilfreich): Die Amminkupferkomplexe sind stabil und labil, die Chromkomplexe sind stabil und inert – die thermodynamische Größe ist von der kinetischen völlig unabhängig! Es scheint allerdings einen Widerspruch zu geben: Wenn der Austausch von Aqua- gegen Amminliganden bei Chrom(III) stark verlangsamt ist, warum verläuft dann der Übergang von Aqua- zu Hydroxido-Liganden genauso schnell wie bei Aluminium und Eisen(III), den beiden anderen Ionen, die mit Ammoniak oder Urotropin als Hydroxide fallen – und zwar im Bruchteil einer Sekunde? Man beantworte diese Frage selbst, indem die Bildung von Hydroxido-Liganden aus Aqua-Liganden durch Deprotonierung der letzteren betrachtet wird: Um Chrom(III)-Hydroxid zu fällen, müssen keine (inerten) Cr-O-Bindungen gelöst werden!
Wie verläuft nun eine Ligandensubstitutionsreaktion im Detail? Die Geschwindigkeit des Austauschs von Aqualiganden ist für eine große Zahl von Zentralmetallen untersucht. Bei den Einzelschritten der Ligandensubstitution kann die dissoziativ von der assoziativ verlaufenden Substitution unterschieden werden, wenn durch druckabhängig gemessene Reaktionsgeschwindigkeiten die Aktivierungsvolumina bekannt sind. Es zeigt sich, dass der Ligandenaustausch bei oktedrischen Komplexen eher dissoziativ verläuft, dass also einer der sechs Liganden den Komplex verlässt, bevor der neue Ligand eintritt. Einer der Steuerparameter dieses Vorgangs kann aufgrund der elektrostatischen Anziehung zwischen Zentralmetall und Ligand erwartet werden, nämlich die Ladungsdichte am Zentralmetall. Je größer diese ist, umso stärker sollte die Abspaltung eines Liganden behindert sein. Der Vergleich mit anderen dreiwertigen Zentralmetallatomen wie Aluminium ergibt, dass für Chrom(III) der dort beobachtete sehr langsame Ligandaustausch durch die Ladung allein nicht ausreichend erklärt wird. Im Folgenden wird daher die chemische Bindung in Koordinationsverbindungen näher untersucht.
Die Chemie der Koordinationsverbindungen der ersten Übergangsreihe, in der das 3d-Niveau aufgefüllt wird, wird durch das Wechselspiel zwischen Hundscher Regel (high-spin-Komplexe) und Aufbauprinzip (low-spin-Komplexe) bestimmt. In der zweiten und dritten Übergangsreihe spielen dagegen high-spin-Komplexe kaum noch eine Rolle, da hier die Metall-Ligand-Bindungen gegenüber der Spinpaarungsenergie dominieren.
Im Folgenden erkennen wir einige der Faktoren, die zur Struktur und zur Elektronenverteilung einer Koordinationsverbindung beitragen, in quantenchemischen Rechnungen am Hexaammineisen(II)-Kation. Für diesen ersten Einstieg wird ein Amminkomplex ausgewählt, da hier Metall-Ligand-π-Wechselwirkungen ohne Bedeutung sind, anschließend kommen wir auf das Hexaaquachrom(III)-Ion zurück.
Die Stabilität von Amminkomplexen variiert sehr stark. Während die zweiwertigen Ionen von Cobalt, Nickel, Kupfer und Zink in wässriger Lösung Amminkomplexe bilden, werden sehr hohe Ammoniak-Konzentrationen im Fall von Eisen benötigt, und der Mangankomplex wurde bisher nur aus flüssigem Ammoniak kristallisiert [mii_6am_1996]. Wir fragen erst später danach, warum das so ist. Hier zuerst das Ergebnis einer quantenchemischen Rechnung am Hexaammineisen(II)-Kation mit einem reinen Dichtefunktional. Kristallstrukturanalysen zeigen ein oktaedrisches Komplexkation mit Fe-N-Abständen von 2.206(8) im Chlorid und 2.215(3) Å im Bromid [mii_6am_1996].
Die Rechnung zeigt als Ergebnis ein sehr schwach gestrecktes Oktaeder, in dem die vier Fe-N-Bindungen einer Ebene (xy) 2.210 Å betragen, während die beiden verbleibenden Bindungen (entlang z) 2.225 Å lang sind.
Für die Grenzorbitale des Hexaammineisen(II)-Komplexes ergibt sich das folgende Schema (zur Nummerierung: der Komplex enthält 24 + 6×10 = 84 Elektronen; beim Zuordnen der Elektronen zu Eisen-3d-Orbitalen nach der Hundschen Regel bleiben 4 ungepaarte Elektronen, es ergeben sich also 44 α- und 40 β-Spins).
Besetzte Grenzorbitale eines [Fe(NH3)6]2+-Komplexkations in einer DFT-Rechnung. α- und β-Spin-Orbitale sind getrennt aufgeführt. Der Komplex ist entlang z leicht gestreckt (technische Anmerkung: bp/def2-tzvp, Orbitale mit 0.04 isovalue gezeichnet).
Die α-Spin-Orbitale sehen so aus (z ist die vertikale Achse):
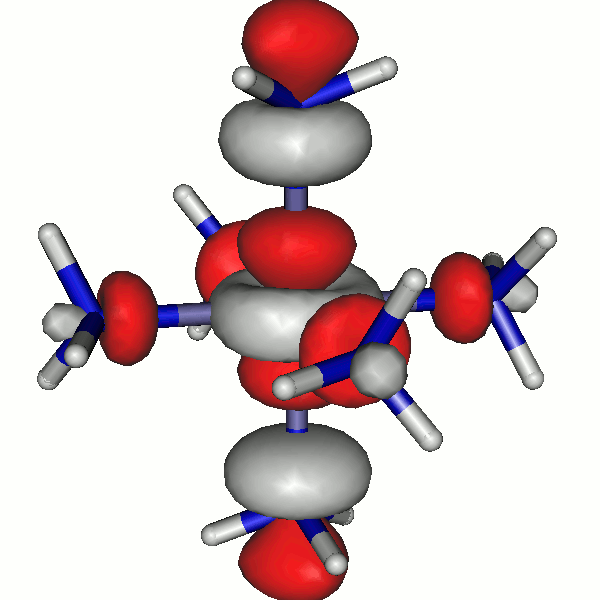
44a
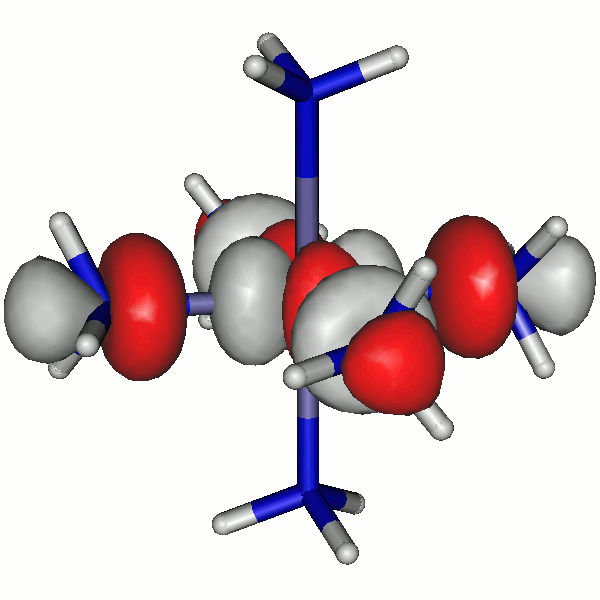
43a
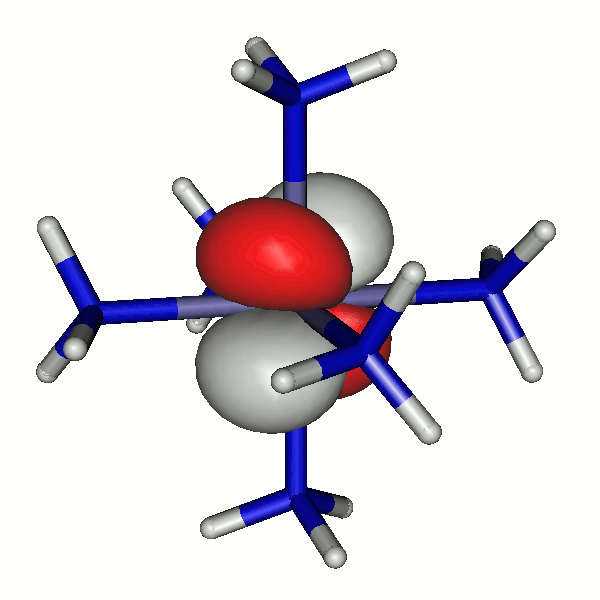
42a
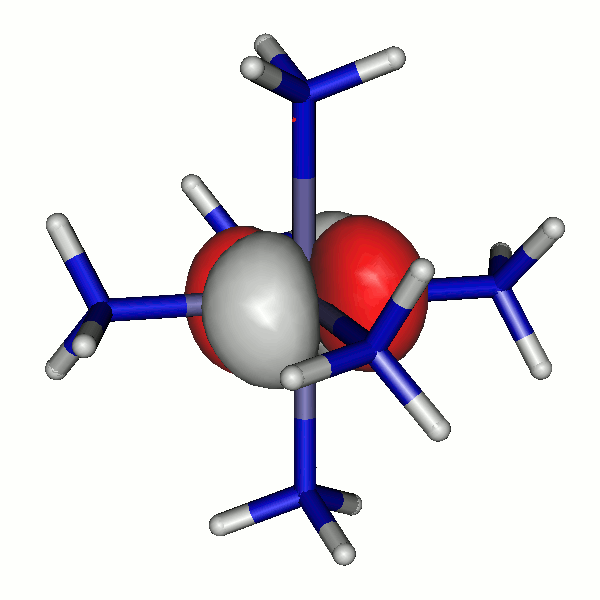
41a
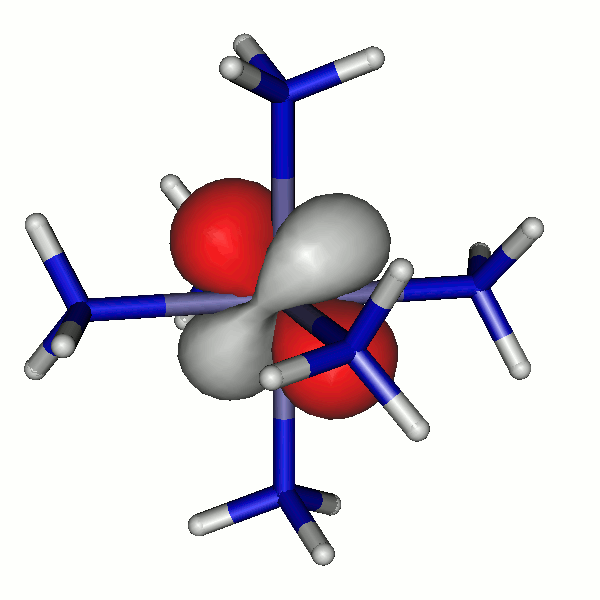
40a
Das einzige besetzte 3d-β-Spin-Orbital hat die folgende Gestalt; es wird deutlich, dass das 42a-α-Elektron und das 40b-β-Elektron dasselbe Orbital besetzen:
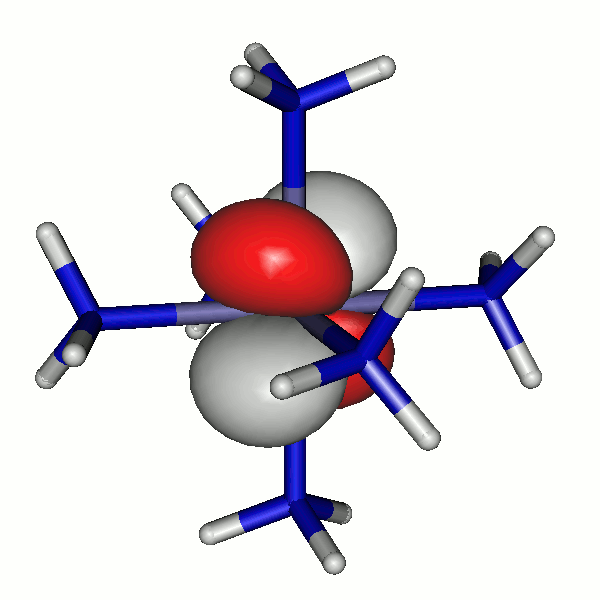
40b
Jetzt zum tieferen Sinn des Ganzen: wir stellen eine Reihe von Beobachtungen zusammen, die wir anschließend analysieren wollen. Es lassen sich die folgenden Eigenheiten erkennen:
• d-Orbitale vom Typ xy, xz und yz sind nichtbindend, während x2−y2 und z2 Fe-N-antibindend sind.
• Bei der Rechnung wird ausgiebig linearkombiniert, 40b ist deutlich zu etwa gleichen Teilen aus xz und yz zusammengesetzt.
• Spinpaarung und Ligandeinflüsse führen im Eisen(II)-Komplex zu vergleichbaren Orbitalenergie-Änderungen: unter den α-Spin-Orbitalen ist das durch den β-Spin belastete Orbital 42a ähnlich destabilisiert wie die beiden Fe-N-antibindenden Orbitale 43a und 44a.
• Das β-Spin-Elektron ist das unstabilste (die Hundsche Regel). Dieses würde bei der Oxidation zu Eisen(III) entfernt.
• Die z-Achse, entlang der sich eine geringfügige Streckung des Oktaeders errechnet hatte, kommt dem doppelt besetzten Orbital am nächsten. Wir werden dieses Phänomen bei der Besprechung der Jahn-Teller-Verzerrung eingehender kennenlernen.
In der Summe lässt sich festhalten, dass das Orbitalschema zwei dominante Einflüsse widerspiegelt: die Spinpaarungsenergie und die Metall-Ligand-Wechselwirkung. Im folgenden werden zuerst diese beiden Parameter eingehend beleuchtet, um anschließend zwei weitere wichtige Einflussgrößen hinzuzunehmen: die Jahn-Teller-Verzerrung, die bei vielen Komplexen deutlich dominanter ist als im Hexaammineisen(II)-Beispiel, und Metall-Ligand-π-Wechselwirkungen, die bei Amminkomplexen keine Rolle spielen.
Typische Energiewerte für die Elektronenabstoßung (einschließlich der Spinpaarungsenergie) bei Übergangsmetallzentren lassen sich erhalten, wenn die Rechnung am Ammineisen-Dikation für das freie Fe2+-Ion wiederholt wird. Im folgenden Schema sind nur die Grenzorbitale berücksichtigt. Insgesamt hat ein Eisen-Dikation 24 Elektronen. Die Grenzorbitale sind die 3d-Orbitale (das 4s-Orbital ist nur beim freien Atom besetzt). Es ergeben sich daher bei deren Füllung nach der Hundschen Regel 14 α- und 10 β-Spin-Elektronen.
Besetzte Grenzorbitale eines Fe2+-Ions in einer DFT-Rechnung. α- und β-Spin-Orbitale sind getrennt aufgeführt. Die Achsen sind willkürlich gewählt und entsprechen nicht der Achswahl in der Abbildung des Komplexes! (Technische Anmerkung: bp/def2-tzvp)
Um mit dem Schema des Amminkomplexes vergleichen zu können, beachten wir, dass die Ordinatenstreckung bei beiden Schemata die gleiche ist. Den Energiewerten selbst wird zuerst keine Bedeutung beigemessen (wir werden sehen, dass die Destabilisierung der Eisenorbitale im Komplex mit einer einfachen Ladungsverschiebung zu tun hat [„Elektronegativitätsausgleich“]). Wir diskutieren die energetische Abfolge im Sinne einer unterschiedlichen Abstoßung zwischen den 3d-Elektronen.
Sie werden sich an den sehr ungezwungenen Umgang quantenchemischer Software mit dem Linearkombinieren von Orbitalen besser gewöhnen, wenn die geläufige Darstellung von d-Orbitalen näher beleuchtet wird.
Die räumliche Ausrichtung der fünf Orbitale einer Schale hängt von den Indizes xy, xz, yz, x2 − y2 und z2 ab; die auf den ersten Blick aus der Reihe fallende Form im z2-Fall kommt durch die rechnerische Überlagerung von Orbitalen zustande, die dem Orbital mit dem Index x2 − y2 entsprechen, und zwar z2 − x2 und z2 − y2; anstelle der Kurzform z2 wird daher auch manchmal die ausführlich geschriebene Summe 2z2 − x2 − y2 oder 3z2 − r2 mit r2 = x2 + y2 + z2 verwendet.
Jetzt zurück zu den Hexaaquametall(III)-Komplexen. Der Grundzustand des d3-Ions Cr3+ ist [Ar]3d3. Um die Valenzschale genauer zu untersuchen, beginnen wir unsere Betrachtung mit einem ähnlichen dreiwertigen Ion, das aber nur ein einziges d-Elektron hat, nämlich Ti3+ mit der Elektronenkonfiguration [Ar]d1. Das d-Elektron hat die Wahl zwischen 5 energiegleichen d-Orbitalen.
Wird aus dem Ti3+-Ion und 6 Wassermolekülen der Komplex [Ti(H2O)6]3+ gebildet, so hat dies Auswirkungen auf die Energie der einzelnen d-Orbitale des Titans. Das einfachste Modell, mit dem sich das veränderte Energieschema für die d-Orbitale beschreiben lässt, ist das Kristallfeldmodell – ein elektrostatisches Modell, in dem die Liganden als negative Punktladungen angesehen werden (6 × •), deren Abstoßung mit den d-Elektronen betrachtet wird. In diesem Abstoßungsmodell zerfallen die fünf d-Orbitale in zwei Gruppen. Die höhere Abstoßung und damit die höhere Energie zeigen Elektronen im x2−y2- und im z2-Orbital, deren Orbitallappen genau auf die herannahenden Punktladungen ausgerichtet sind. Weniger abgestoßen werden Elektronen in den drei untereinander ebenfalls energiegleichen xy-, xz- und yz-Orbitalen, deren Orbitallappen sich in günstigerer Weise zwischen den negativen Punktladungen befinden.
Bei oktaedrischer Symmetrie (Punktgruppe Oh) haben die beiden weniger stabilen Orbitale das Symmetriesymbol eg, die drei gegenüber dem Schwerpunkt abgesenkten Orbitale haben das Symmetriesymbol t2g. Der Energieunterschied zwischen den beiden Orbitalgruppen im oktaedrischen Komplex wird 10 Dq oder auch Δo genannt. Da im d1-Fall keine Elektronenabstoßung innerhalb der 3d-Unterschale beachtet werden muss, kommt das folgende Diagramm einem Orbitalschema nahe. Man beachte vor allem, dass die vermehrte Abstoßung entlang der Achsen dort auftritt, wo im Molekülorbitalschema eine antibindende Wechselwirkung formuliert wurde.
Die Möglichkeit eines d-Elektrons, Lichtenergie aufzunehmen, dadurch 10 Dq zu überwinden und so von seinem t2g-Grundzustand für kurze Zeit in den angeregten eg-Zustand überzugehen (um anschließend unter Energieabgabe wieder in den Grundzustand zurückzukehren), ist eine der Ursachen für die Farbe von Übergangsmetall-Komplexen. Um für das Beispiel des [Ti(H2O)6]3+-Ions die Farbe quantitativ zu beschreiben, wird eine Lösung benötigt, die sicher nur diese eine farbige Spezies enthält, zum Beispiel eine deutlich saure Lösung von Titan(III)-perchlorat in Perchlorsäure (warum nicht Salzsäure, warum überhaupt Säure? Man vergleiche die Reaktionen des hydratisierten Aluminium-Ions). Das Absorptionsspektrum dieser Lösung zeigt eine sich über den gesamten sichtbaren Bereich erstreckende breite Bande, deren Absorptionsmaximum bei ca. 500 nm liegt (maximale Absorption bei gelb, das Auge sieht dann die Komplementärfarbe violett).
Die Intensität der Absorption ist mit ca. 5 L mol−1 cm−1 recht gering. Im ultravioletten Bereich nimmt die Absorption dann noch einmal stark zu. Während die Ursache der UV-Absorption erst in einer weiteren Lehreinheit zusammen mit der Beobachtung besprochen wird, wieso die Farbe der Lösung nur blass ist, soll hier das Kristallfeldmodell weiter benutzt werden. Die Wellenzahl von ca. 20 000 cm−1, bei der die höchste Absorption gemessen wird, wird beim Hexaaquatitan(III)-Ion mit 10 Dq gleichgesetzt. Es ist üblich, die Abszisse in Wellenzahlen – dem Kehrwert der Wellenlänge – in cm−1 einzuteilen, da diese eine Energieeinheit sind. Dabei wird meist von der höheren zur niedrigen Energie hin abgetragen – also mit steigender Wellenlänge. Um eine Wellenlänge λ in nm (Nanometer) in eine Wellenzahl umzurechnen, muss wegen 1 cm = 107 nm, 107 nm cm−1 durch λ dividiert werden. Das sichtbare Spektrum erstreckt sich daher von 25000 cm−1 (= 107 nm cm−1 dividiert durch 400 nm) bis 12500 cm−1 (800 nm). Die Breite der Bande wird durch Schwingungen der Liganden relativ zum Zentralmetall gedeutet. Bei der höchstsymmetrischen Schwingung, bei der alle sechs Liganden in gleichem Takt auf das Zentralmetall zu- und wieder wegschwingen, wird 10 Dq im Takt der Schwingung größer und kleiner – es entsteht die beobachtete breite Bande. Eine weitere deutlich sichtbare Eigenschaft der Absorptionsbande – ihre unsymmetrische Gestalt – wird im Kapitel „Jahn-Teller-verzerrte Komplexe“ aufgegriffen.
Die nächste Beobachtung, die mit Hilfe des Kristallfeldmodells gedeutet werden soll, ist die am Beginn der Betrachtung stehende kinetische Hemmung des Ligandaustauschs bei Chrom(III)-Komplexen. In der Reihe der Hexaaqua-Komplexe [MIII(H2O)6]3+ mit MIII = Sc, Ti, V, Cr verlangsamt sich die Aqualigand-Austauschgeschwindigkeit sehr deutlich mit der Zahl der d-Elektronen, die in der Reihe Sc3+, Ti3+, V3+, Cr3+, 0, 1, 2 und 3 beträgt. Mit der d-Elektronenzahl ändert sich aber auch eine wichtige Energiegröße, die aus dem Kristallfeldmodell abgeleitet werden kann, nämlich die Kristall- oder Ligandfeldstabilisierungsenergie („CFSE“, „LFSE“ von engl. Crystal oder Ligand Field Stabilization Energy). Hierzu wird wie im Bild oben die energetische Lage der drei t2g- und der zwei eg-Orbitale relativ zu einem gedachten Schwerpunkt betrachtet. Die Energie 10 Dq spaltet sich dann auf in eine Absenkung der drei stabilisierten Orbitale um −4 Dq und eine Anhebung der beiden destabilisierten Orbitale um 6 Dq (siehe oben). Ist zum Beispiel jedes d-Orbital mit 1 Elektron besetzt, so ergibt sich keine Stabilisierungsenergie, denn: 3 × (−4 Dq) + 2 × 6 Dq = 0. Anders sieht die Bilanz aus, wenn eg-Orbitale unbesetzt bleiben. Bei 0, 1, 2 und 3 Elektronen ergeben sich LFSE-Werte von 0, −4, −8 und −12 Dq. Soll aus dem Hexaaqua-Komplex des Chrom(III) ein Aqua-Ligand entfernt werden – der erste Schritt beim dissoziativ verlaufenden Ligandaustausch – so verringert sich nach dem Kristallfeldmodell die Zahl der die d-Elektronen abstoßenden negativen Punktladungen und damit die Kristallfeldaufspaltung. Wird die Feldaufspaltung kleiner, verringert sich aber auch die LFSE. Je größer dabei die LFSE des Ausgangskomplexes ist, umso größer fällt der Verlust aus – der im Verlauf einer Ligandsubstitutionsreaktion als benötigte Aktivierungsenergie erscheint, deren Betrag über die Austauschgeschwindigkeit entscheidet.
Warum sollte sich in der Realität eine Stabilisierung ergeben, nur wenn einige Orbitale unterhalb einer gedachten Linie liegen? Dass die Folgerungen aus dem Kristallfeldmodell durchaus brauchbar sind, zeigt eine quantitative Behandlung, die darüberhinaus vor allem eine Idee zur Natur der LFSE vermittelt. Hierzu betrachten wir eine Folge computerchemischer Strukturoptimierungen an den Hexaaquametall(III)-Kationen der Elemente Scandium bis Eisen. In den Lehrbüchern finden Sie Auftragungen zahlreicher Energiewerte über die d-Elektronenzahl, zum Beispiel Gitterenergien von Metall(II)-chloriden, Hydratationsenthalpien zwei- oder dreiwertiger 3d-Ionen und Ähnliches. Die Zahlenwerte dieser Energien sind immer dann groß, wenn kleine Metall-Ligand/Gegenion-Abstände auftreten. Wir interpretieren in diesem Sinne die folgende Abbildung, die anstelle von Energiewerten die Metall(III)-O(Aqualigand)-Gleichgewichtsabstände zeigt.
Berechneter M-O-Abstand in Hexaaquametall(III)-Komplexkationen als Funktion der d-Elektronenzahl (Sc: 0, …, Fe: 5). Die blaue Linie verbindet drei Kationen mit kugelsymmetrischer Elektronenverteilung: das d0-Sc-, das high-spin-d5-Fe-, und, nicht dargestellt, das d10-Ga-Hexaaqua-Trikation (technische Anmerkung: bp/tzvp).
Als Erwartungswert beim Gang durch eine Periode des PSE dient die blaue Linie. Entlang dieser sollten die M-O-Abstände abnehmen (Bindungs-, Gitter- und Solvatationsenergien ansteigen), wenn keine besonderen elektronischen Effekte den Einfluss der steigenden Ordnungszahl modifizieren. Diese aber gibt es offensichtlich. Wir machen uns klar, dass die ersten drei d-Elektronen in solche Orbitale eingefüllt werden (t2g in Oh), die den Liganden „aus dem Weg gehen“ und so deren Annäherung weniger behindern als dies eine isotrope Elektronenverteilung täte.
Die Bedeutung der Abstoßung zwischen Metall-d- und Ligandelektronen wird besonders im d4-Fall deutlich: Reicht, wie in diesem Fall, die Kristallfeldaufspaltung nicht als Kompensation der Spinpaarungsenergie aus, folgt der Einbau des vierten Elektrons der Hundschen Regel. Es bleibt dafür nur eines der eg-Orbitale. Dies aber behindert die Annäherung der Liganden stark – im Kristallfeldmodell durch elektrostatische Abstoßung, im MO-Schema durch eine Antibindung. Die Folge ist dem Mn-Punkt der Graphik zu entnehmen: die oktaedrische Anordnung der sechs Liganden ist stark gestört; es ist zu einer „Jahn-Teller-Verzerrung“ gekommen, auf die später noch näher eingegangen wird. Das folgende Bild zeigt diese M-O-antibindende Wechselwirkung des höchsten besetzten Orbitals des [Mn(H2O)6]3+-Ions.
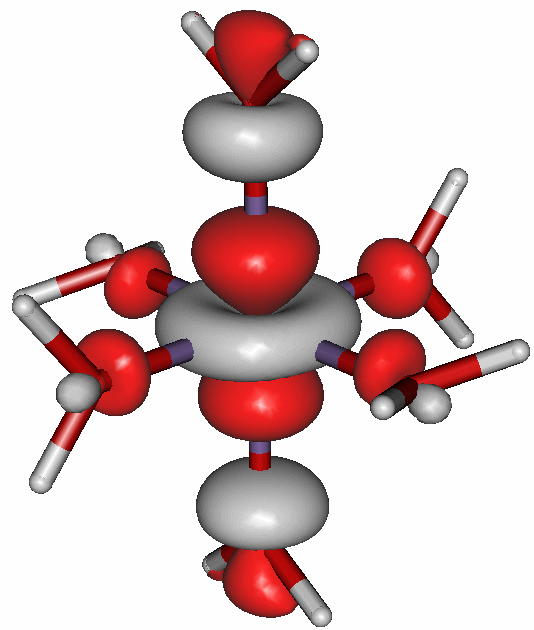
Das α-HOMO (43a) des gestreckt oktaedrischen Ions [Mn(H2O)6]3+. Die gestreckte Achse verläuft vertikal (technische Anmerkung: bp/tzvp, isovalue 0.06).
Vor der Vertiefung der Jahn-Teller-Verzerrung soll die Deutung der Spektren weiter entwickelt werden, indem tetraedrische Komplexe sowie die spektroskopischen Auswahlregeln behandelt werden.
Das Kristallfeldmodell kann auch für andere Ligandanordnungen aufgestellt werden. Eine wichtige Anordnung neben der oktaedrischen ist die tetraedrische, die unter den bisher besprochenen Komplexen beim Tetrahydroxido-aluminat auftrat. Eine zum Oktaeder analoge Betrachtung zeigt, dass nun die Orbitale x2 − y2 und z2 stabilisiert sind, während die xy-, xz- und yz-Orbitale eine höhere Abstoßung erfahren. Das Aufspaltungsschema scheint daher umgekehrt wie im Fall des Oktaeders zu sein, man beachte aber die verschiedene Wahl der cartesischen Koordinaten. Wegen der fehlenden Zentrosymmetrie des Tetraeders lautet die Symmetriebezeichnung nun e und t2, vor allem aber beträgt die Aufspaltung für die gleiche Zentralmetall-Ligand-Kombination nur ungefähr die Hälfte der Oktaederaufspaltung:
Δt = 4/9 Δo ≈ 1/2 Δo
Die Regel hilft bei der Interpretation der Farben von Komplexen. Ein tetraedrischer Komplex wird zum Beispiel gebildet, wenn eine Cobalt(II)-nitrat-Lösung, die als farbige Komponente („Chromophor“) das [CoII(H2O)6]2+-Ion enthält, mit reichlich konzentrierter Salzsäure versetzt wird. Unter diesen Bedingungen bildet sich durch Austausch der sechs Aqua-Neutralliganden durch vier anionische Chlorido-Liganden das Tetrachloridocobaltat(II), [CoCl4]2− (wir diskutieren, was gegen ein Hexachloridocobaltat(II) spricht; ferner vergleichen wir für denselben Liganden die LFSE für einen tetraedrischen und für einen oktaedrischen Komplex des d7-Ions Cobalt(II); was fällt auf?) Der mit dem Ligandaustausch verbundene Farbwechsel ist deutlich: die schwach rosafarbene Cobalt(II)-nitrat-Lösung wird tintenblau. Die Änderung der Farbe kann nach den bisher erkannten Regeln erwartet werden. Unter der Annahme, dass ein Chlorido- und ein Aqua-Ligand nicht zu stark verschiedene Kristallfeldaufspaltungen hervorrufen (dies wird unter dem Stichwort „spektrochemische Reihe“ weiter unten behandelt), ist vor allem die Halbierung der Aufspaltung durch den Wechsel von der oktaedrischen zur tetraedrischen Struktur zu beachten. Die Anregung eines Elektrons sollte also beim Chloridokomplex weniger Energie benötigen, die absorbierte Strahlung sollte zur energiearmen Seite des Spektrums verschoben sein, also ins Rote. Die nicht-absorbierte Strahlung – die unser Auge als Farbe wahrnimmt – sollte in Richtung Blau verschoben sein, was sich mit der Beobachtung deckt.
Wie aber kommt es zu der starken Zunahme der Intensität der Farbe? Dies ist Ausdruck spektroskopischer Auswahlregeln, welche die Bedingungen nennen, ob eine Anregung durch die zur Verfügung stehende Strahlung physikalisch möglich ist. Hier sind zwei Regeln abzufragen: Das Laporte-Verbot und das Spin-Verbot.
Das Laporte-Verbot lässt sich zweckmäßig in zwei Abfragen aufteilen: (1) Ist der Komplex zentrosymmetrisch (inversionssymmetrisch; symmetrisch in Bezug auf die Punktspiegelung)? Wenn nein (zum Beipiel ein Tetraeder), dann ist die Anregung erlaubt; wenn ja (zum Beispiel ein Oktaeder), so ist (2) zu fragen: Ändert sich bei der Anregung die Parität des Orbitals? Die Parität beschreibt das Verhalten des Orbitals bei der Punktspiegelung; bleibt es unverändert, ist die Parität „gerade“, kurz „g“ (s- und d-Orbitale), wechseln die Orbitallappen das Vorzeichen, ist die Parität „ungerade“, kurz „u“ (p- und f-Orbitale). Eine Anregung durch Licht ist nur erlaubt, wenn sich die Parität ändert, wenn ein Elektron also zum Beispiel aus einem p- in ein d-Orbital angeregt wird. Kristallfeldübergänge, bei denen Elektronen aus einem d- in ein d-Orbital angeregt werden, sind also in oktaedrischen und anderen zentrosymmetrischen Komplexen verboten, in tetraedrischen und anderen nicht-zentrosymmetrischen Komplexen hingegen erlaubt. Dass das [CoII(H2O)6]2+-Ion überhaupt eine Farbe zeigt, beruht auf Vorgängen, die das Laporte-Verbot berühren. Unter den Schwingungen, welche die Liganden relativ zum Zentralmetall ausführen, sind solche, die die Zentrosymmetrie kurzzeitig aufheben, so dass eine Elektronenanregung möglich wird.
Die zweite maßgebliche Auswahlregel ist das Spin-Verbot. Eine Anregung ist nur dann erlaubt, wenn sich der Gesamtspin nicht ändert, wenn also vor und nach der Elektronenverschiebung dieselbe Zahl ungepaarter Spins vorliegt. d5-Ionen wie [MnII(H2O)6]2+ oder [FeF6]3−, bei denen alle fünf d-Orbitale einfach und mit gleichem Spin besetzt sind (Hundsche Regel), sind aufgrund des Spinverbots farblos – es kann hier keine Anregung formuliert werden, bei der eine Spinpaarung im eg-Niveau vermieden wird.
[mii_6am_1996]
R. Eßmann, G. Kreiner, A. Niemann, D. Rechenbach, A. Schmieding, T. Sichla, U. Zachwieja and H. Jacobs:
Isotype Strukturen einiger Hexaamminmetall(II)-halogenide von 3d-Metallen: [V(NH3)6]I2, [Cr(NH3)6]I2, [Mn(NH3)6]Cl2, [Fe(NH3)6]Cl2, [Fe(NH3)6]Br2, [Co(NH3)6]Br2 und [Ni(NH3)6]Cl2.
Z. Anorg. Allg. Chem. 1996, 622, 1161–1166.
doi:
10.1002/zaac.19966220709
Die durch die ungleiche Besetzung von x2−y2- und z2-Orbitalen verursachte starke Verzerrung des Hexaaquamangan(III)-Oktaeders tritt bei anderen Komplexen mit dieser Besonderheit in der gleichen Weise auf. Ein vollständigeres Diagramm für neun existierende und zwei hypothetische (Sc und Ti) Hexaaquametall(II)-Komplexkationen ist in der folgenden Graphik dargestellt:
Berechneter M-O-Abstand in Hexaaquametall(II)-Komplexkationen als Funktion der d-Elektronenzahl (Ca: 0, …). Die blaue Linie verbindet drei Kationen mit kugelsymmetrischer Elektronenverteilung: das d0-Ca-, das high-spin-d5-Mn-, und das d10-Zn-Hexaaqua-Dikation (technische Anmerkung: bp/tzvp). Sc und Ti sind eingeklammert, da hier bisher kein Hexaaquametall(II)-Ion synthetisiert wurde.
Die starke berechnete Streckung des Oktaeders im Chrom(II)- und Kupfer(II)-Hexaaqua-Ion wird durch das Experiment bestätigt. Für das [CrII(H2O)6]2+-Ion liegt eine Röntgenstrukturanalyse am Doppelsalz (NH4)2[CrII(H2O)6](SO4)2 vor, bei der vier der sechs Aqua-Liganden in quadratischer Anordnung mit Cr-O-Abständen von 2.08 Å gefunden werden; die dazu senkrecht stehenden verbleibenden beiden Liganden sind, in sehr guter Übereinstimmung mit dem Rechenergebnis am Kation, 2.39 Å vom Zentralatom entfernt. Das [CuII(H2O)6]2+-Ion wurde mit zahlreichen Gegenionen kristallisiert. Ein Beispiel mit größerer Abweichung von der Rechnung erinnert daran, dass sich die Näherungen der Rechnung (Methode, Basissatz) und der Einfluss von Kation-Anion-Kontakten in realen Kristallstrukturen zu größeren Abweichungen zwischen Rechnung und Messung addieren können. So betragen im Perchlorat [Cu(H2O)6](ClO4)2; die Abstände zwischen dem Zentralmetall und den Sauerstoffatomen der vier Aqua-Liganden in der Äquatorebene 1.95 Å, senkrecht dazu 2.38 Å:
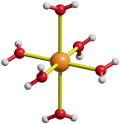
Ein, wenn auch geringeres, Ausweichen der Liganden aus der Oktaederposition kann auch für solche Komplexe angenommen werden, bei denen die Orbitale des Typs xy, xz und yz ungleich besetzt sind. Im Folgenden wird dargestellt, (1) dass mit dem Kristallfeldmodell entschieden werden kann, ob überhaupt eine Verzerrung zu erwarten ist, (2) dass die d-Orbitalreihenfolge im Falle einer Verzerrung näherungsweise mit dem Kristallfeldmodell bestimmt werden kann, und (3) ob sich auch eine schwache Verzerrung experimentell bestätigen lässt.
Beim ersten Punkt geht es um die Frage, wie eine zu erwartende Abweichung von einer hohen Symmetrie schnell erkannt werden kann. Gehen Sie folgendermaßen vor: Zeichnen Sie im Fall eines sechsfach koordinierten Komplexes das Aufspaltungsschema nach dem Kristallfeldmodell hin. Füllen Sie nun die vorhandenen Elektronen ein. Gibt es nur eine einzige Möglichkeit, dies zu tun, ist keine Verzerrung zu erwarten. Dies ist bei Besetzung der Orbitale nach der Hundschen Regel der Fall bei der d3-, d5- und d8-Konfiguration. In den übrigen Fällen kann mehr als eine Möglichkeit für eine bestimmte Elektronenanordnung formuliert werden kann. Für das d9-Ion Cu2+ zum Beispiel lassen sich zwei Möglichkeiten hinzeichnen:
Beide Anordnungen haben dieselbe Energie, sie sind energetisch entartet, hier: doppelt oder zweifach entartet. Energetisch entartete Zustände sind instabil; sie lassen sich durch eine Verzerrung der hochsymmetrischen Struktur unter Energiegewinn aufheben. Erfolgt im Beispiel die Verzerrung derart, dass das doppelt besetzte eg-Orbital energetisch abgesenkt und das einfach besetzte angehoben wird, so resultiert wegen der ungleichen Besetzung ein Energiegewinn, da bei der Absenkung zwei Elektronen stabilisiert werden, die Anhebung jedoch nur ein Elektron destabilisiert. Die Verzerrung entarteter Zustände unter Verlust von Symmetrie und Gewinn an Stabilität heißt Jahn-Teller-Verzerrung. Das hier an potentiell oktaedrischen Komplexen abgeleitete Verfahren ist gilt auch für andere Koordinationsfiguren. Leiten Sie zur Übung ab, dass paramagnetische tetraedrische Komplexe unverzerrt auftreten, wenn die Elektronenkonfiguration d2, d5 oder d7 ist.
Der Vorgang lässt sich im Rahmen des Kristallfeldmodells anschaulich darstellen. Werden – wie bei der Rechnung und der Kristallstrukturanalyse gefunden – zwei trans-ständige Liganden vom Zentralatom wegbewegt, so stabilisieren sich wegen der nun verringerten Abstoßung zwischen der negativen Ladung am Ligand und den d-Elektronen die Orbitale, die die größte Wechselwirkung mit diesen Liganden aufweisen. Wird als Richtung für die Oktaederstreckung die z-Achse gewählt, so wird das z2-Orbital am stärksten abgesenkt, während das xz- und das yz-Orbital eine geringere Stabilisierung erfahren. Im folgenden Diagramm ist dieser Sachverhalt skizziert unter der Annahme, dass die Summe der Orbitalenergien unverändert bleibt.
Die gezeigte einfache Ableitung von Orbitalenergieabfolgen ist eine Stärke des Kristallfeldmodells. Wir werden später durch die gleichen Überlegungen quadratisch-planare Komplexe bequem analysieren und erst bei der Betrachtung von Metall-Ligand-π-Wechselwirkungen die Grenzen des Modells erfahren.
Das erhaltene Schema soll hier noch zur Deutung des Spektrums des [CuII(H2O)6]2+-Ions herangezogen werden. Da die übrigen Orbitale gefüllt sind, kann eine Anregung nur in das x2−y2-Orbital erfolgen. Wegen des Spinverbots kann außerdem nur ein Elektron mit β-Spin (↓) angeregt werden. Ein Übergang x2−y2 ← z2 benötigt so wenig Energie, dass er nicht im sichtbaren Bereich beobachtbar sein wird; es werden also nur zwei Anregungen erwartet: eine mit geringerer Energie aus dem xy- und eine mit höherer Energie aus dem xz- oder yz-Orbital. Die Form der Absorptionsbande lässt in Übereinstimmung mit dieser Überlegung den Schluss zu, dass sie aus zwei Komponenten besteht.
Man vergleiche mit dem gemessenen Spektrum (sowie mit dem oben abgebildeten Spektrum des Hexaaquatitan(III)-Ions):
Die Jahn-Teller-Verzerrung ist bei hexakoordinierten Komplexen mit d4- und d9-Konfiguration in Experiment und Rechnung sehr deutlich. Prinzipiell sollten sie aber auch bei den d-Elektronenanordnungen d1, d2, d6, und d7 auftreten. Bei der Rechnung zeigen sich solche Verzerrungen, allerdings um ca. 1 Größenordnung schwächer als für die d4/d9-Komplexe.
Ein Beispiel ist das [TiIII(H2O)6]3+-Ion.
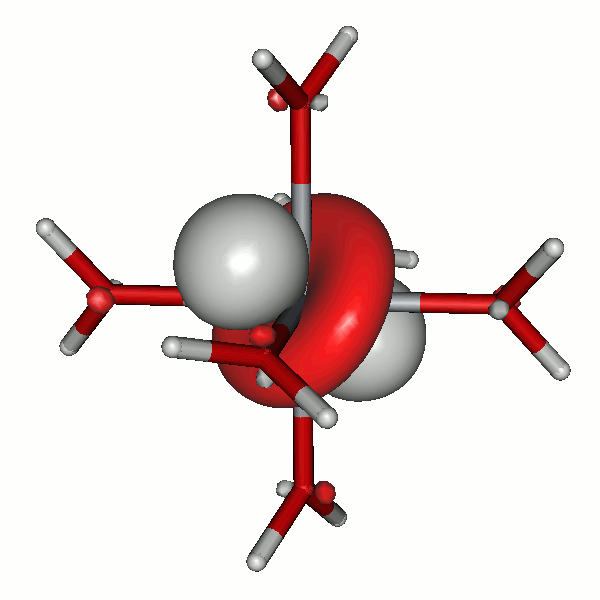
Das α-HOMO (40a) des schwach trigonal verzerrten Ions [Ti(H2O)6]3+. Die das 40a-Orbital einschließenden Ti-O-Bindungen stehen in 90.8°-Winkeln zueinander, die einzelnen Ti-O-Abstände sind gleich (techn. Anm.: bp/tzvp, isovalue 0.06).
Die Abbildung unterstreicht einige Regeln. So lässt sich oft nicht die Richtung vorhersagen, in der die Verzerrung erwartet werden darf. Im d1-Fall erscheint die Besetzung eines xy-Orbitals zusammen mit einer Stauchung entlang z als plausible Möglichkeit (die aus einer Rechnung sicher als nur wenig unstabiler hervorgehen dürfte). Auf dem gewählten theoretischen Niveau ist es aber eine schwache trigonale Verzerrung, die dem energetischen Minimum entspricht. Im Einklang mit der trigonalen Verzerrung wird das 40a-Elektron auch nicht in einem der Orbitale vom Typ xy, xz und yz gefunden, sondern Sie sehen im Bild eine Linearkombination aus allen drei Orbitalen.
Der wichtigste Punkt jedoch: die Verzerrung ist hier und bei den übrigen Fällen dieses Kapitels klein, und zwar kleiner als die oben angesprochenen Einflüsse, denen ein Aquakation als Baustein einer Salzstruktur ausgesetzt ist. Dies und die Möglichkeit, dass ein kleiner JT-Effekt dynamisch auftreten kann, verhindert in aller Regel dessen strukturanalytischen Nachweis in d1-, d2-, ls-d4-, ls-d5-, hs-d6- und hs-d7-Komplexen.
Wir beschließen das Kapitel mit einer anderen Eigenschaft des [TiIII(H2O)6]3+-Ions: wieso zeigt das Elektronenspektrum dieses Ions trotz der kaum merklichen JT-Verzerrung eine Bandenaufspaltung, die der im Aquakupfer-Komplex nicht nachsteht? Ein Schlagwort dabei wird das Franck-Condon-Prinzip sein, das andere das Laporte-Verbot.
Wir haben bisher verzerrte und unverzerrte oktadrische sowie tetraedrische Komplexe kennengelernt. Die IUPAC hat in ihrem Red Book von 2005 eine Reihe von Polyedersymbolen eingeführt, die zu einer einfachen Beschreibung der Ligandenanordnung führen soll. Die Idee ist dabei die, dass ein Komplex wie das schwach JT-verzerrte [Ti(H2O)6]3+-Ion oktaedrisch aussieht, aber nicht zu einer der kubischen Punktgruppen T oder O gehört (die Symmetriegruppe des Aquatitan-Ions in der abgebildeten Konformation ist zum Beispiel S6). Auch alle bisher behandelten Aqua- und Ammin-Komplexe haben keineswegs Oh-Symmetrie, wie man nach einer Lehrbuchlektüre glauben könnte, da durch die H-Atome die vierzählige Symmetrie der Gruppe Oh gebrochen wird. Die IUPAC berücksichtigt genau das durch das Polyedersymbol. Für oktaedrische Komplexe ist dies OC-6 und meint irgendwelche Komplexe, bei denen irgendwelche sechs Liganden etwas bilden, das wie ein Oktaeder aussieht. Weitere Symbole sind zum Beispiel (eine vollständige Liste finden Sie in Tabelle IR-9.2 der Nomenclature of Inorganic Chemistry): T-4 für tetraedrische, SP-4 für quadratisch planare, SS-4 (von see-saw) für wippenförmige (ein Oktaeder, bei dem ein cis-Ligandenpaar fehlt), TBPY-5 für trigonal-bipyramidale und SPY-5 für quadratisch-pyramidale Komplexe. Die Analyse von Strukturen, die zwischen den idealen Polyedern liegen, ist nicht immer trivial und hat zu Versuchen geführt, Polyeder durch geeignete Parameter quantitativ zu definieren (shape measures, hierzu mehr in der Koordinationschemie II).
An das Polyedersymbol anhängen lässt sich der Konfigurationsindex, mit dessen Hilfe Strukturen eindeutig beschrieben werden können.
Das Spektrum von [CrIII(H2O)6]3+ zeigt im sichtbaren Bereich zwei Banden. Die Natur dieser Übergänge lässt sich aus der Elektronenkonfiguration plausibel machen. Wie beim [TiIII(H2O)6]3+-Ion dient die absorbierte Lichtenergie zur Anhebung eines Elektrons aus dem t2g- in das eg-Niveau. Im Unterschied zum d1-Fall werden nun jedoch unterschiedliche Energiebeträge benötigt, um zum Beispiel vom xy-Orbital in das x2−y2-Orbital oder das z2-Orbital anzuregen. Die Ursache ist die Abstoßung der Elektronen untereinander. Bei der Anregung von xy zu z2 verdichtet das angeregte Elektron Ladungsdichte im Bereich um die z-Achse, in dem bereits halbgefüllte Orbitale mit z-Komponente vorhanden sind, nämlich xz und yz. Neben 10 Dq muss daher eine zusätzliche Abstoßung überwunden werden. Dies entfällt bei der Anregung von xy zu x2−y2, da hier der Aufenthaltsraum des Elektrons lediglich in der xy-Ebene um 45° gedreht wird. Durch die gleiche Überlegung lassen sich die übrigen möglichen Übergänge in zwei Gruppen einteilen. Die Anregungen bei niedriger Energie, bei der nur 10 Dq überwunden wird, lassen sich zu einem Satz von drei energetisch entarteten Anregungen zusammenfassen:
Auch die Übergänge bei höherer Energie, die zusätzlich die vermehrte Abstoßung zwischen den Elektronen enthalten, bilden einen Satz dreifach entarteter Anregungen:
Da die niederenergetische Absorption frei von Beträgen aus zusätzlicher Elektronenabstoßung ist, kann deren Energie mit 10 Dq gleichgesetzt werden.
Ein ähnliches Bild kann für das d8-Ion [NiII(H2O)6]2+ erwartet werden. Man beachte in den folgenden Schemata, dass die drei Elektronen mit β-Spin (↓) die gleichen Aufspaltungsmuster in einer gleichbleibenden Umgebung von fünf α-Spins (↑) ergeben wie die drei Elektronen im Chrom(III)-Komplex. Wegen der kleineren Oxidationsstufe werden zwei Absorptionen bei niedrigerer Energie erwartet. Das gemessene Spektrum ist daher etwas unerwartet. Es treten zwar zwei zu niedriger Energie verschobene („rotverschobene“) Banden auf – auf die Ursache der Aufspaltung der Bande bei 700 nm wird noch kurz eingegangen –, die dritte Absorption am Rand des sichtbaren Bereichs zum Ultravioletten hin ist jedoch neu. Im folgenden Bild ist das grüne Spektrum das des Aquanickelkomplexes; das violette Spektrum, auf das später eingegangen wird, ist das des Hexaamminnickel(II)-Ions:
Da die Energie dieser dritten Absorption ungefähr dem doppelten der Anregung eines Elektrons entspricht, liegt die Vermutung nahe, dass hier zwei Elektronen über die 10-Dq-Barriere gehoben werden, wodurch das eg-Niveau voll besetzt wird. Auch diese Anregung ist energetisch dreifach entartet, so dass sich für das [NiII(H2O)6]2+-Ion insgesamt drei Sätze dreifach entarteter Anregungen ergeben, von denen die beiden mit niedrigerer Energie den Übergängen entsprechen, die beim Chrom(III)-Komplex beobachtet wurden, nämlich:
und
Der Anregung zweier Elektronen aus dem t2g- in das eg-Niveau entsprechen diese drei energiegleichen Übergänge:
Die letzten Überlegungen zeigen, dass es einen ziemlichen Aufwand darstellt, sich für jeden Komplex neu zu überlegen, wie das beobachtete Spektrum zu deuten ist. Es wäre sehr hilfreich, eine schematisches Verfahren benutzen zu können, wie ein dn-Spektrum aussehen sollte. Eine Hilfe bieten verschiedene Arten von Korrelationsdiagrammen, von denen die Tanabe-Sugano-Diagramme die bekanntesten sind. Solche Diagramme oder die ihnen zugrunde liegenden Formeln werden nicht nur für die Deutung von Spektren benötigt, sondern auch, um aus den Energiewerten der einzelnen Banden grundlegende Größen wie die Feldaufspaltung 10 Dq zu ermitteln. Es ist nämlich nicht immer so, dass sich 10 Dq wie bei den Aquachrom(III)- und Aquanickel(II)-Ionen als Energie der langwelligen Bande ergibt. Das d2-Ion [VIII(H2O)6]3+-Ion ist ein Beispiel für einen Komplex, bei dem die Anregung eg ← t2g offensichtlich zu einer Verminderung der Abstoßung zwischen den Elektronen führt: 10 Dq ist bei diesem Beispiel etwas größer als die Energie der langwelligen Bande. Ein Tanabe-Sugano-Diagramm hilft, das d2-Spektrum zu entschlüsseln.
Vollständige Tanabe-Sugano-Diagramme enthalten alle nur denkbaren Anregungen, auch spinverbotene (siehe zum Beipiel die Diagramme in I.-P- Lorenz: Molekülsymmetrie und Spektroskopie ). Um die stärkeren Absorptionen deuten zu können, reicht es aber meist, nur die spinerlaubten Übergänge zu betrachten, also solche, bei denen sich der Gesamtspin gegenüber dem Grundzustand nicht ändert („meist“ heißt natürlich, dass es Ausnahmen gibt; unter den lehrbuchüblichen Spektren trifft dies auf das oben abgebildete Spektrum des Aquanickel-Ions zu; hier ist die Bande bei 700 nm deutlich aufgespalten, da zu der erlaubten Anregung eine spinverbotene mit fast gleicher Energie hinzukommt und dieser „Intensität stiehlt“). Bei Korrelationsdiagrammen ist der Spin-Zustand in der Regel als „Multiplizität“ 2 S + 1 angegeben, beim d3-Ion Cr3+ mit einem S=3/2-Grundzustand also 4, beim d8-Ion Ni2+ mit einem S=1-Grundzustand also 3. Die Multiplizität ist bei dem Symbol, das den elektronischen Zustand kennzeichnet (dem „Termsymbol“), oben links angegeben. Bei Chrom(III) bezeichnen Terme wie 4A2g oder 4T2g die gesuchten elektronischen Zustände mit einem Gesamtspin von 3/2, bei Nickel(II)-Komplexen sind die entsprechenden Terme vom Typ 3T2g. Das d2-Vanadium(III)-Zentrum liegt ebenfalls im Triplett-Grundzustand vor. Das folgende Schema zeigt ein Tanabe-Sugano-Diagramm für d2-Komplexe, in dem nur Terme mit der Multiplizität des Grundterms eingetragen sind – also Triplett-Terme –, so dass nur die hier interessierenden spinerlaubten Übergänge erscheinen. Auf der Abszisse ist die Kristallfeldaufspaltung aufgetragen, auf der Ordinate die Energie der angeregten Zustände relativ zum Grundzustand (der daher auf der Abzisse liegt). Beide Achsen sind in Einheiten des Racah-B-Parameters eingeteilt. Dieser beschreibt die Abstoßung zwischen Elektronen gleichen Spins; für viele Übergangsmetall-Ionen liegt B sehr ungefähr bei 1000 cm−1, so dass die meisten Komplexe auf der Abszisse ungefähr im Bereich zwischen 10 und 30 B gefunden werden. Genauere Werte für einige zwei- und dreiwertigen Ionen sind in der folgenden Tabelle zusammengefasst (nach Lever, S. 115):
| M | B(M2+)/cm−1 | B(M3+)/cm−1 |
|---|---|---|
| Ti | 718 | |
| V | 766 | 861 |
| Cr | 830 | 918 |
| Mn | 960 | 1140 |
| Fe | 1058 | |
| Co | 971 | 1100 |
| Ni | 1041 | |
| Cu | 1240 |
Dem Diagramm können einige Einzelheiten unmittelbar entnommen werden, die zum Teil schon angeklungen waren:
Das Tanabe-Sugano-Diagramm eines d8-Komplexes sieht sehr ähnlich aus. Der Grundzustand des Nicht-Jahn-Teller-Ions [Ni(H2O)6]2+ trägt erwartungsgemäß das Symmetriesymbol „A“, ferner sind alle angeregten Zustände dreifach entartet – so wie es sich oben ergeben hatte. Die Gesamtzahl von drei Banden ist unmittelbar ersichtlich, die Zwei-Elektronen-Anregung beim Übergang mit der höchsten Energie fällt durch die Steigung von ungefähr 2 des obersten Astes sofort ins Auge. Werden aber die einzelnen Mikrozustände den Termen zugeordnet , so fällt auf, dass die Bande mit der zweithöchsten Energie, welche durch die Anregung eines Elektrons in einen Zustand mit vermehrter Abstoßung zustande kommt, nicht wie erwartet aus dem 3P-Term, sondern aus dem Grundzustand des Atoms herrührt – was die Überlegungen zum d2-Fall einigermaßen auf den Kopf stellt. Hier wird eine Besonderheit sichtbar, nämlich das „Überkreuzungsverbot“. Würden die beiden oberen Linien des Diagramms durch die beiden gestrichelten Linien ersetzt, würde das Diagramm der Erwartung entsprechen. Anders aber als im d2-Fall tragen nun die beiden sich überkreuzenden Linien dasselbe Symmetriesymbol 3T1g. In diesem Fall greift das hier nicht näher begründete Verbot, dass die Terme der Überkreuzung aus dem Weg gehen, in dem es zum Austausch der Zustände kommt. Dieser Fall tritt in Tanabe-Sugano-Diagrammen oft auf: Immer, wenn eine gebogene Linie auftritt, gibt es eine zweite Linie mit demselben Symmetriesymbol und entgegengesetzter Krümmung (vulgo: „die Terme stoßen sich ab“).
Auf die formale Gleichbehandlung von d8- und d3-Spektren war schon hingewiesen worden. Dies zeigt sich natürlich auch bei den Tanabe-Sugano-Diagrammen. Beide Diagramme sind gleich, lediglich die Beschriftung hat sich wegen der unterschiedlichen Konfigurationen und Spinmultiplizitäten geändert.
Es sollte also auch beim [CrIII(H2O)6]3+-Ion eine dritte Absorption beobachtet werden, die jedoch wegen des größeren Wertes für 10 Dq weit außerhalb des Sichtbaren im ultravioletten Bereich des elektromagnetischen Spektrums liegt. Wird dieser Bereich in die Messung eingeschlossen, so wird tatsächlich diese Bande bei einer Energie von 37 800 cm−1 (265 nm) gefunden – beinahe verdeckt durch eine in diesem Energiebereich rasch anwachsende, intensive Absorption, auf deren Ursache noch einzugehen sein wird.
Bei der Umsetzung des violetten [CrIII(H2O)6]3+-Komplexions mit einem Überschuss Alkalihydroxid in wässriger Lösung entsteht das grüne Hexahydroxidochromat(III) [CrIII(OH)6]3−. Die Farbe zeigt an, dass die Kristallfeldaufspaltung kleiner ist als beim Aqua-Komplex. Entsprechend sind die Kristallfeldübergänge rotverschoben, sie erscheinen bei größeren Wellenlängen (darauf, dass die Zwei-Elektronenanregung durch eine jetzt weiter aus dem UV-Bereich hereinragende starke Absorption verdeckt wird, wird am Schluss dieser Lehreinheit eingegangen):
Im Sinne eines Punktladungsmodells wie es die Kristallfeldtheorie darstellt, wäre natürlich eher das Gegenteil zu erwarten, nämlich dass das höher beladene Hydroxido-O-Atom eine stärkere Feldaufspaltung erzeugt als ein Wasser-O-Atom. Die beiden Chromkomplexe sind jedoch keine Einzelfälle. Das Kristallfeldmodell ist allgemein ungeeignet, den Betrag von 10 Dq plausibel zu machen. Dies wird deutlich, wenn die Beiträge von Zentralmetall und Liganden zu 10 Dq separiert werden. Die Feldaufspaltung lässt sich hierzu gemäß
10 Dq = gM · fL
als Produkt aus einem Metall- und einem Ligandbeitrag darstellen. Einige Werte sind in den folgenden beiden Tabellen zusammengestellt.
| M | gM/1000 cm−1 |
|---|---|
| MnII | 8.0 |
| CoII | 9 |
| NiII | 8.7 |
| FeIII | 14.0 |
| CrIII | 17.4 |
| CoIII | 18.2 |
| RhIII | 27.0 |
| IrIII | 32 |
Die Reihung der Liganden mit steigenden fL-Werten ist die spektrochemische Reihe:
| L | fL |
|---|---|
| Br− | 0.72 |
| Cl− | 0.80 |
| F− | 0.9 |
| OH− | 0.9 |
| ox2− | 0.99 |
| H2O | 1.00 |
| py | 1.23 |
| NH3 | 1.25 |
| en | 1.28 |
| bpy | 1.33 |
| CN− | 1.7 |
Es wird deutlich, dass zum einen die große Spannweite der gM-Werte nicht nachvollziehbar ist, zum anderen scheint die negative Beladung des Liganden für seinen Beitrag zu 10 Dq unerheblich zu sein – der Eindruck ist vielmehr, dass die typischen anionischen Liganden eher kleine Feldaufspaltungen verursachen. Der Grund für diese irritierenden Feststellungen liegt in der Schwäche des Kristallfeldmodells, nur am Zentralmetall, nicht aber am Liganden Orbitale zu betrachten. Dies soll im Folgenden in zwei Schritten getan werden.
Im ersten Schritt werden Metall-Ligand-Wechselwirkungen betrachtet, die lokale σ-Symmetrie aufweisen. Hierunter fallen zum Beispiel koordinative Bindungen zwischen einem Lewis-sauren Zentralmetall und Lewis-basischen Liganden. Die Elektronenpaare der Liganden binden in diesem Fall in die leeren oder teilweise besetzten Valenzorbitale des Metallatoms. Bei Zentralmetallen der ersten Übergangsreihe („3d-Metalle“) sind dies die (teilweise besetzten) 3d- sowie die (leeren) 4s- und 4p-Orbitale, die insgesamt Platz für 18 Elektronen bieten. Aus dem folgenden Molekülorbitalschema geht hervor, dass sich bindende und antibindende Wechselwirkungen zwischen passenden Ligandgruppenorbitalen und sechs der neun Metallorbitale konstruieren lassen, lediglich die Wechselwirkung der drei t2g -Orbitale aus der 3d-Unterschale mit den Ligandorbitalen bleibt nichtbindend; 10 Dq ist nun die Energiedifferenz zwischen t2g und eg*, wie später noch näher erläutert wird:
Da der Fall besetzter antibindender t1u- und a1g-Orbitale nicht vorkommt, verwenden wir für die weitere Diskussion eine verkürzte Version dieses Schemas. Man beachte ferner, dass bei dieser qualitativen Behandlung die energetische Abfolge der Orbitale eg, a1g und t1u zwar typisch, aber zuerst einmal willkürlich ist:
Der Bezug zum Kristallfeldmodell wird deutlich, wenn Elektronen in dieses Schema eingefüllt werden. als Beispiel soll das Hexaaquachrom(III)-Kation betrachtet werden. Die sechs Aqualiganden tragen insgesamt sechs Elektronenpaare bei, das Zentralmetall drei α-Spin-Elektronen:
Bisher wurde die Bindung zwischen Zentralatom und Ligand als koordinative oder polare kovalente Bindung mit lokaler σ-Symmetrie verstanden. π-Wechselwirkungen sind möglich, wenn Metall-d- und Ligand-p-Orbitale in der folgenden Weise angeordnet sind (dargestellt ist eine antibindende Wechselwirkung):
In einem oktaedrischen ML6-Komplex kommen auf diese Weise bindende und antibindende Molekülorbitale hinzu, zu denen das Zentralmetall xy-, xz- und yz-Orbitale beiträgt (dargestellt ist die xy-Ebene mit einem von drei entarteten bindenden MOs und dem entsprechenden antibindenden MO mit t2g-Symmetrie):
π-Wechselwirkungen zwischen gefüllten Ligandorbitalen und leeren, teilweise, oder ganz gefüllten Metallorbitalen scheinen bei den Liganden möglich, die in der spektrochemischen Reihe bei kleinen fL zu finden sind. So verfügt ein Fluorido-Ligand über drei besetzte p-Orbitale. Eines davon bindet mit lokaler σ-Symmetrie an das Zentralmetall (die Bindung wird eine s-Orbital-Beteiligung aufweisen, die im Rahmen des VB-Modells Hybridisierung genannt würde). Die übrigen beiden p-Orbitale stehen senkrecht auf der M-L-Bindung und können sich an der abgebildeten Wechselwirkung beteiligen.
In der Punktgruppe Oh zerfallen die 6 × 2 = 12 Orbitale dieses Typs gemäß t1g + t1u + t2g + t2u. Die Wechelwirkung zwischen den Metall-t2g- und dem Ligandgruppen-t2g-Orbitalsatz wurde bereits in der Abbildung oben skizziert. Die Rassen t1g und t2u kommen bei den Metallorbitalen nicht vor, sie sind Metall-Ligand-nichtbindend. Die zusätzliche Ligand-Metall-t1u-Wechselwirkung stabilisiert die entsprechenden σ-Bindungen. Wie das aussieht, sehen wir uns nach der formalen Behandlung in einem quantitativen Beispiel an, im folgenden Schema ist diese ergänzende Wechselwirkung für's Erste vernachlässigt. Durch π-Wechselwirkungen verändert sich daher das Schema der sechs σ-M-L-Wechselwirkungen (links) in der rechts dargestellten Weise:
Die Auswirkung von π-Wechselwirkungen auf 10Dq wird deutlich, wenn nun wieder Elektronen eingefüllt werden. Bei einem oktaedrischen Chromkomplex wären dies die 15 schon zuvor berücksichtigten Elektronen, hinzu kommen 3 Elektronenpaare in den t2g-Ligandgruppenorbitalen. Es wird deutlich, dass die drei zuvor nichtbindenden t2g-Elektronen nun in einem antibindenden t2g*-Orbital destabilisiert sind. Die Abbildung verdeutlicht sehr schematisch, dass eine M-L-π-Wechselwirkung den Wert für 10Dq verkleinert, dass also π-basische Liganden in der spektrochemischen Reihe bei kleinen fL-Werten erwartet werden dürfen. („Sehr schematisch“ deswegen, weil bei einem realen Beispiel eine Veränderung von Liganden, zum Beispiel die Deprotonierung wenig π-basischer Aqua-Liganden zu stark π-basischen, anionischen Hydroxido-Liganden das ganze Schema durcheinanderwirbelt, auch den σ-Bereich.)
Im Spektrum des [CrIII(H2O)6]3+-Ions fällt neben den drei Kristallfeldbanden eine intensive Absorption auf, die bei ca. 250 nm einsetzt und mit zunehmender Energie (abnehmender Wellenlänge) schnell an Intensität gewinnt. Im Spektrum von [CrIII(OH)6]3− erscheint diese starke Absorption bei so viel geringerer Anregungsenergie, dass sie den Zwei-Elektronen-Kristallfeldübergang verdeckt. Die MO-Schemata erlauben eine Interpretation dieser Absorptionen.
Neben den Kristallfeldübergängen (d-d) zwischen Orbitalen mit vorwiegendem Metall-d-Anteil (im Schema ist der wesentliche Beitrag durch doppelte Unterstreichung hervorgehoben), können Elektronen aus dem Bereich der ligandständigen Orbitale in MOs mit hohem Metallanteil angeregt werden. Eine solche Anregung verschiebt ein Elektron aus der Ligandsphäre zum Metall, was einer Reduktion des Metalls und einer Oxidation des Liganden für die Dauer der Anregung entspricht. Wegen der Ladungsübertragung werden solche Anregungen „charge-transfer-Übergänge“ (CT-Übergänge) genannt. Die hier gezeigte Art des charge transfers – vom Ligand zum Metall – ist ein „LMCT-Übergang“ (Ligand-to-Metal Charge Transfer). Er ist sowohl mit Aqua- als auch mit Hydroxido-Liganden möglich. Bei den letzteren erscheint er bei geringerer Anregungsenergie, da die Orbitalenergien des Anions OH− höher – näher beim Metall – liegen als beim Neutralligand Wasser; ein Elektron ist aus dem Anion leichter zu entfernen als aus dem Neutralmolekül.
Bei einem CT-Übergang wird ein Elektron aus einem (ungeraden) p-Orbital in ein (gerades) d-Orbital angeregt, der Übergang ist also auch in einem zentrosymmetrischen Komplex Laporte-erlaubt. Da sich CT-Übergänge stets auch spinerlaubt formulieren lassen, sind CT-Absorptionen intensiv. Sie fallen besonders auf, wenn d-d-Übergänge spin- und Laporte-verboten sind, die Verbindung also keine Kristallfeldfarbe aufweist. Beispiele sind Eisen(III)-Verbindungen wie FeCl3 (orange-gelb), FeBr3 (dunkelbraun) oder der für den Eisen(III)-Nachweis genutzte tiefrote Thiocyanato-Komplex. Ferner fallen die intensiven CT-Übergänge dort auf, wo wegen des Fehlens von d-Elektronen keine Kristallfeldübergänge möglich sind. Ein Beispiel ist die tiefviolette Farbe des d0-Ions Manganat(VII), MnO4−.
Man beachte auch die zahlreichen Trends im Periodensystem: Die Ionisierungsenergien sinken in der Reihe Fluorid > Chlorid > Bromid > Iodid, es fällt also immer leichter, das Halogenid zu oxidieren. Dementsprechend verändern sich die Farben der Kupfer(II)-halogenid-Hydrate, die für F, Cl und Br dieselbe quadratisch-planare [Cu(H2O)2X2]-Einheit enthalten, die durch zwei weiter entfernte Halogenidoliganden der Nachbarmoleküle zu einem stark gestreckten Oktaeder ergänzt ist. Kupfer(II)-fluorid-Dihydrat ist rein blau (im Sichtbaren tritt nur der Kristallfeldübergang auf), Kupfer(II)-chlorid-Dihydrat ist türkis (blau + gelb; gelb wegen einer CT-Absorption im Blauen, also bei hoher Energie), Kupfer(II)-bromid-Tetrahydrat ist grün (intensiverer CT-Übergang im Blauen, der eine deutlichere Gelbkomponente beimischt), Kupfer(II)-iodid ist unbekannt. Werden Kupfer(II) und Iodid zusammengegeben, entstehen Iod und Kupfer(I)-iodid. Kupfer(I) neben dem elementaren Halogen ist beim Chlorid und Bromid der durch CT-Anregung mit zunehmend geringerer Energie erzeugte angeregte Zustand. Beim Iodid findet der Elektronenübergang bei „negativer Anregungsenergie“ statt – er wird zum Grundzustand, das Reaktionsgemisch reagiert in einer Redox-Reaktion vollständig unter Elektronenübertragung – also unter charge transfer.
Was von diesen qualitativ abgeleiteten Dingen zeigt eine computerchemische Rechnung? Das folgende Schema zeigt eine Analyse des d5-Komplexanions Hexafluoridoferrat(III). Die fünf d-Elektronen sind nach der Hundschen Regel über die fünf d-Orbitale verteilt („high-spin“). Gegenüber einem reinen σ-M-L-Schema sind die Orbitalgruppen t1u und t2g durch Wechselwirkungen vom π-Typ aufgespalten – t2g mehr, t1u weniger.
Energie der α-Spin-Orbitale aus einer DFT-Rechnung an [FeF6]3−. Alle gezeigten Orbitale sind doppelt besetzt, außer denjenigen, bei denen ein α-Spin eingezeichnet ist; die β-Spinelektronen haben um eine ca. 1 eV höhere Energie; licht eingezeichnete Niveaus haben aus Symmetriegründen keinen Metallanteil (techn. Anm.: Gaussian09, ublyp/tzvp, Fe-F: 2.032 Å).
Es ist lehrreich, einige MOs näher anzuschauen. Die beiden eg*-Orbitale (43 und 44) zeigen erneut, wie formal der scheinbare Unterschied zwischen einem x2−y2- und einem z2-Orbital ist. Die beiden Orbitale sind auch hinsichtlich ihrer Gestalt sichtlich äquivalent (siehe hierzu auch einen didaktischen Beitrag: [equivalent_eg_orbitals_2008]):
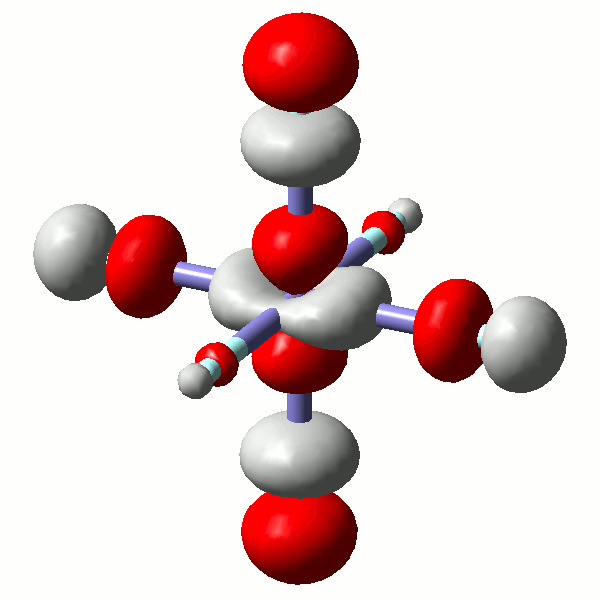
Das α-Spin-Orbital 44 in [FeF6]3− (isovalue = 0.06)
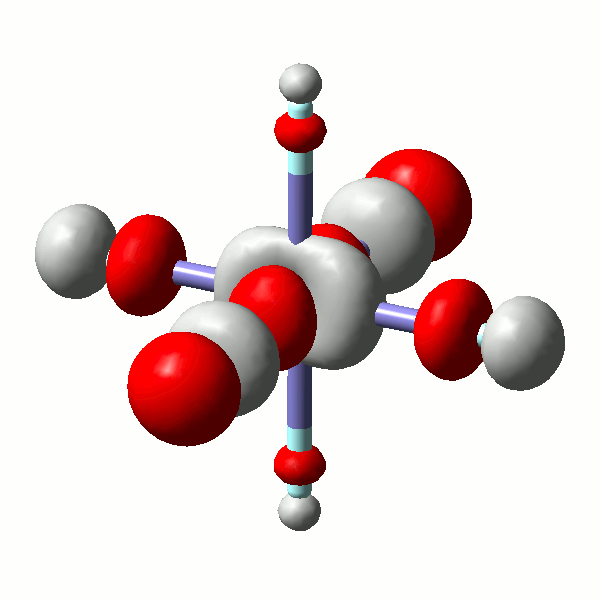
Das α-Spin-Orbital 43 in [FeF6]3− (isovalue = 0.06)
Die Wechselwirkung eines Metall-t2g-Orbitals mit einem passenden Ligandgruppenorbital ist für die yz-Ebene im folgenden Bild am Beispiel des antibindenden MOs dargestellt.
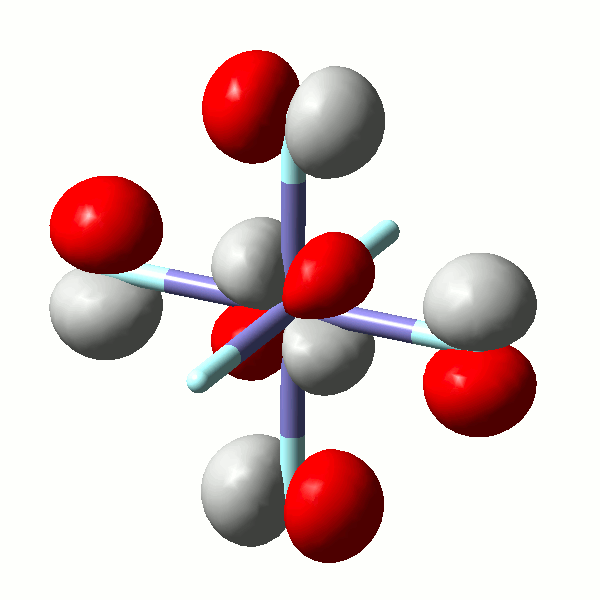
Das α-Spin-Orbital 37 in [FeF6]3− (isovalue = 0.06)
Durch π-artige Wechselwirkungen modifiziert und in ein bindendes und ein antibindendes Niveau aufgespalten ist schließlich die t1u-Orbitalgruppe des σ-Falles, zu dem das Metall die leeren p-Orbitale seiner Valenzschale beiträgt. Dargestellt ist die antibindende Wechselwirkung, was aufgrund des recht diffusen, beim gewählten Funktionswert (der „isovalue“ beträgt 0.06) nicht erkennbaren, Metallanteils nicht sichtbar ist.
Das α-Spin-Orbital 32 in [FeF6]3− (isovalue = 0.06)
[equivalent_eg_orbitals_2008]
K. Brandhorst, J. Grunenberg and M. Tamm:
Two Equivalent eg Orbitals for the Discussion of Bonding in Octahedral Complexes.
Journal 2008, 85, 1692.
doi:
10.1021/ed085p1692
Viele Komplexverbindungen der Übergangsmetalle sind paramagnetisch und ein Großteil der Erkenntnisse zur Chemie dieser Verbindungen wurde aus magnetischen Daten abgeleitet („Magnetochemie“). Eine paramagnetische Substanz wird in ein magnetisches Feld mit einer Kraft hineingezogen, die proportional dem Produkt aus der Feldstärke und dem Feldgradienten ist. Der Paramagnetismus einer Verbindung wird im allgemeinen durch das Vorhandensein ungepaarter Elektronen in Ionen, Atomen oder Molekülen verursacht. Jedes dieser Elektronen besitzt ein definiertes paramagnetisches Moment, das in Abwesenheit eines äußeren Magnetfeldes existiert. Eine diamagnetische Substanz wird von einem äußeren Magnetfeld abgestoßen – in gewissem Umfang hat die gesamte Materie diese Eigenschaft. Diamagnetisches Verhalten ist auf kleine magnetische Momente zurückzuführen, die durch das Magnetfeld induziert werden, jedoch in Abwesenheit des Feldes nicht existieren. Auf diese Weise induzierte Momente sind dem angelegten Magnetfeld entgegengerichtet und verursachen so die Abstoßung der Probe. Kompliziertere Formen magnetischen Verhaltens (Ferro- und Antiferromagnetismus sowie Ferrimagnetismus) werden hier nicht betrachtet. Das paramagnetische Verhalten eines Komplexes wird durch seine ungepaarten Elektronen bestimmt, die ein bestimmtes magnetisches Moment aufweisen. Dieses setzt sich aus zwei Komponenten, dem Spinmoment und dem Bahnmoment zusammen.
Für die meisten Komplexverbindungen der 3d-Elemente (für 4d- und 5d-Elemente ist dies wegen der ausgeprägteren Spin-Bahn-Kopplung komplizierter) kann die zweite Komponente für unsere Betrachtungen in guter Näherung vernachlässigt werden. Die magnetische Suszeptibilität (χ, auf molare Größen bezogen: χm) wird somit im wesentlichen nur durch die Anzahl ungepaarter Elektronen (n) bestimmt und läßt sich mit der sogenannten „spin-only-Formel“ berechnen.
Es gilt:
χm ∝ μeff2
μeff ist die Zahl der effektiven Bohrschen Magnetonen (engl. effective Bohr magneton number); μeff ist dimensionslos. Da für den Gesamtspin S gilt: S = n/2, gelten für den spin-only Fall die folgenden zwei Formeln:
μeff = 2 [S(S + 1)]1/2, und
μeff = [n(n + 2)]1/2.
Für 1 bis 5 ungepaarte Elektronen wird so erhalten:
| n | μeff |
|---|---|
| 1 | 1.73 |
| 2 | 2.83 |
| 3 | 3.87 |
| 4 | 4.90 |
| 5 | 5.92 |
Für die Bestimmung von χm sind verschiedene Methoden anwendbar, zum Beispiel die Faradaysche Waage. Für die Angabe der magnetischen Suszeptibilität ist es wichtig, zwischen folgenden Größen zu unterscheiden: a) Volumensuszeptibilität (χ, dimensionslos), b) Grammsuszeptibilität (χg, in m3 kg−1; Dichte einbezogen) und c) molare Suszeptibilität (χm, in m3 mol−1; molare Masse der Verbindung einbezogen).
Wie oben angedeutet, kann die Bestimmung des magnetischen Momentes dazu beitragen, den Molekülbau einer neu synthetisierten Substanz vorherzusagen. So können Komplexe des NiII der Koordinationszahl 4 zum einen als Tetraeder oder aber als quadratisch-planare Moleküle vorliegen (wovon ist dies abhängig?). Die Tetraederkomplexe sind paramagnetisch entsprechend zwei ungepaarten Elektronen, wohingegen quadratisch-planare Komplexe von NiII Diamagnetismus aufweisen. Eine Suszeptibilitätsmessung würde also Hinweise darüber geben, welche Struktur vorliegt oder auszuschließen ist.
Im Gegensatz zu den Halogeniden ist das Pseudohalogenid Cyanid ein Starkfeldligand, der zu einer Feldaufspaltung führt, die laut seines fL-Wertes 1.7 mal so groß ist wie beim Aqua-Liganden. Die beiden entsprechenden Chrom(III)-Komplexe bestätigen dies: Einem Wert für 10 Dq mit 17 400 cm−1 beim Aqua-Komplex stehen 26 600 cm−1 beim Hexacyanidochromat(III) gegenüber; der Quotient weicht mit 1.53 nicht zu stark von 1.7 ab und verdeutlicht die zu erwartende Streuung bei solchen in Näherung gültigen Beziehungen. Überraschend aber ist der Befund bei Eisen(II). Für das Hexaaqua-eisen(II)-Ion beträgt 10 Dq 10 400 cm−1, die Feldaufspaltung beim Hexacyanidoferrat(II) beträgt jedoch 32 200 cm−1 anstatt des Erwartungswertes von 15–20 000 cm−1! Als Schlüssel zum Verständnis dieser Werte erweist sich der Magnetismus der Komplexe. Salze, die das [FeII(H2O)6]2+-Ion enthalten, sind aufgrund ungepaarter Elektronen paramagnetisch, sie werden in ein Magnetfeld hineingezogen. Die Messung ergibt 4 ungepaarte Spins pro Eisenatom. Hexacyanidoferrat(II) dagegen ist diamagnetisch, es gibt keine ungepaarten Spins in diesem Komplex. Der Befund für das Aqua-Ion ist der erwartete. Entsprechend dem linken Aufspaltungsschema
ergeben sich in Übereinstimmung mit der Messung 4 ungepaarte Spins pro Eisenatom. Die d-Orbitale wurden – so wie bisher stets – im Einklang mit der Hundschen Regel gefüllt. Die Formulierung von so vielen parallelen Spins wie möglich führt zu maximaler Austausschenergie. Die Austauschenergie kann als Größe verstanden werden, die eine verminderte Abstoßung von Elektronen gleichen Spins aufgrund einer korrelierten Bewegung beschreibt. Antiparallele Elektronenspins führen zu höherer Abstoßung, so dass bei der Kopplung zweier Spins in einem oder in verschiedenen Orbitalen Energie aufzuwenden ist – die Spinpaarungsenergie. Der für das Cyanidoferrat beobachtete Diamagnetismus, der die Paarung aller Spins im Sinne des rechten Schemas anzeigt, setzt daher eine so große Kristallfeldaufspaltung voraus, dass der Gewinn an Ligandfeldstabilisierungsenergie von 10 Dq pro Elektron die aufzuwendende Spinpaarungsenergie zumindest aufwiegt. Diese Frage, ob nach der Hundschen Regel aufgefüllt wird (high-spin-Komplexe) oder nach dem Aufbauprinzip (low-spin-Komplexe), stellt sich für die Elektronenkonfigurationen d4, d5, d6 und d7.
High- und low-spin-Komplexe unterscheiden sich in ihrer Chemie drastisch. Die Ursache lässt sich ahnen, wenn für ein Metall 10-Dq-Werte aufgelistet werden. Für Eisen(II)-Komplexe ergeben sich folgende Werte:
| 10 Dq/cm−1 | Spinzustand | |
|---|---|---|
| [FeII(H2O)6]2+ | 10 400 | hs |
| [FeII(CNO)6]4− | 27 000 | ls |
| [FeII(CN)6]4− | 32 200 | ls |
Die größte Aufspaltung, die bei high-spin-Eisen(II)-Komplexen gefunden wird, beträgt ca. 13 000 cm−1, die kleinste Aufspaltung für den low-spin-Fall liegt bei über 20 000 cm−1. Es scheint keine Komplexe zu geben, deren Feldaufspaltung innerhalb des doch recht großen Bereichs von ca. 13–20 000 cm−1 liegen. Eine Erklärung für diese Beobachtung ergibt sich, wenn Liganden untersucht werden, die zu einer Feldaufspaltung führen, welche die Spinpaarungsenergie bei einer gegebenen Temperatur gerade eben kompensiert. Oberhalb dieser Temperatur liegt dann der Zustand höherer Unordnung vor, also die entkoppelten Spins der high-spin-Form, unterhalb bildet sich der höher geordnete low-spin-Komplex. Das Phänomen, das hier beschrieben ist, heißt spin-crossover. Für Eisen(II) tritt es zum Beispiel mit dem zweizähnigen Stickstoffliganden 2-Picolylamin („2-pic“) auf, der ein Mittelding ist zwischen den Standardliganden en und bpy, und mit dem einzähnigen Stickstoffliganden Propyl-tetrazol („ptz“):
Für high- und low-spin-Zustände von Salzen mit dem [FeII(2-pic)3]2+- und dem [FeII(ptz)6]2+-Kation sind sowohl Strukturdaten als auch spektroskopische Daten mit ein und demselben Liganden bekannt:
| hs-[FeII(2-pic)3]2+ | ls-[FeII(2-pic)3]2+ | |
|---|---|---|
| Fe–N/Å | 2.195 | 2.005 |
| hs-[FeII(ptz)6]2+ | ls-[FeII(ptz)6]2+ | |
|---|---|---|
| Fe–N/Å | 2.180 | |
| 10 Dq/cm−1 | 12 250 | 20 050 |
Es wird klar, warum der 13–20 000-cm−1-Bereich als 10 Dq bei Eisen(II)-Komplexen nicht vorkommt: Wird die für die Spinkopplung erforderliche Feldaufspaltung erreicht, kommt es zum Übergang zum low-spin-Komplex. Damit verlassen zwei Elektronen antibindende eg*-Orbitale und besetzen nicht-bindende t2g-Zustände. Die Bindungsordnung steigt und der Metall-Ligand-Abstand sinkt. Mit einem fast verdoppelten Wert für 10 Dq bei gleichem Liganden hat sich der Beitrag des Metalls zu 10 Dq stärker verändert als durch einen Wertigkeitswechsel. Durch die große Energielücke zwischen nichtbindenden t2g- und antibindenden eg*-Orbitalen bleibt das eg*-Niveau bei starkem Feld bevorzugt leer. Hieraus ergibt sich eine Elektronenabzählregel: Bei einem oktaedrischen Komplex steuern 6 σ-Donorliganden 12 Elektronen zum MO-Schema des Komplexes bei. Bei schwachem Feld können t2g- und eg*-Orbitale besetzt sein. Zwischen den Grenzen d0 und d10 ergeben sich so insgesamt 12–22 Elektronen. Mit wachsender Feldaufspaltung wird die Besetzung der antibindenden eg*-Orbitale zunehmend ungünstig, so dass sie bei starkem Feld leer bleiben – die Komplexe weisen 12–18 Elektronen auf.
Besonders wichtige Liganden, die eine hohe Feldaufspaltung herbeiführen können, sind die isoelektronischen, zweiatomigen Teilchen CN−, CO und NO+, die in der Regel mit dem jeweils weniger elektronegativen Atom so an das Metall binden, dass eine lineare Anordnung entsteht, also M–C–N, M–C–O und M–N–O. Zwei dieser Liganden kommen zum Beispiel gemeinsam vor im Natrium-pentacyanido-nitrosyl-ferrat(II) („Natrium-nitroprussid“), Na2[Fe(CN)5NO] · 2 H2O.
Zumindest beim Cyanid ist dessen Stellung in der spektrochemischen Reihe auf den ersten Blick verwunderlich. Cyanid ist ein Pseudohalogenid, das eine den Halogeniden prinzipiell ähnliche Orbital-Anordnung aufweist. Ein wesentlicher Unterschied ist jedoch die Verteilung der Orbitale über zwei Atome, von denen das weniger elektronegative die Bindung zum Metall aufbaut. Das Prinzip ist im folgenden MO-Schema für den Neutralligand Kohlenmonoxid dargestellt:
Die Valenzorbitale des CO-Moleküls. Die Ordinate gibt nur für die besetzten Orbitale realistische Werte an (die Energie eines unbesetzten Orbitals ist ohnehin so eine Sache). Die gestrichelten blauen Linien zeigen die Position der Atomkerne an (techn. Anm.: mp2/tzvp, isovalue 0.04).
Den für die π-Basizität eines Halogenido-Liganden verantwortlichen zwei p-Orbitalen entsprechen hier die beiden energetisch entarteten 1π-Orbitale, von denen im Schema das in der Zeichenebene liegende Orbital dargestellt ist; ein zweites Orbital gleicher Gestalt und gleicher Energie, das in der Horizontalen um 90° gekippt ist, ist der Übersichtlichkeit halber weggelassen. Durch die bevorzugte Lokalisierung am elektronegativeren Atom – also abgewandt von dem im Schema von links angreifenden Metall – wird seine Wechselwirkung mit dem Zentralmetall als unerheblich eingeschätzt. Viel deutlicher auf das Metall sind dagegen die Grenzorbitale gerichtet, das 3σ-Orbital und die beiden energetisch höher liegenden, zweifach entarteten 2π-Orbitale, von denen wieder nur eines dargestellt ist.
Beide Orbitaltypen sind geeignet, mit einem sich von der Kohlenstoffseite nähernden Metallatom bindende und antibindende Wechselwirkungen einzugehen. Der 3σ-Zustand kann mit Metallorbitalen vom Typ eg eine σ-Wechselwirkung aufbauen, die beiden höherliegenden 2π-Zustände haben die passende Symmetrie, um mit Metall-t2g-Orbitalen eine π-Wechselwirkung einzugehen, wie sie bei den π-basischen Liganden dargestellt wurde.
Der wesentliche Unterschied zu den π-basischen Liganden ist nun die Besetzung der Grenzorbitale. Das stabilere Orbital ist mit zwei Elektronen besetzt, es resultieren – so wie bei allen bisher besprochenen Liganden – σ-Donor-Eigenschaften. Die beiden zum Metall hin π-bindenden Orbitale aber sind im freien Ligand antibindend und leer! Eine Bindung zum Metall kann nur dann entstehen, wenn das Metall über gefüllte t2gOrbitale verfügt. Wegen der Kombination von bindendem σ- und antibindendem π*-Orbital ist der Ligand eine σ-Base und zugleich eine π-Säure.
Das Molekülorbital-Schema des Komplexes wird durch die leeren antibindenden Ligandorbitale in ähnlicher Weise modifiziert wie im Fall eines π-basischen Liganden. Der Unterschied besteht in der höheren Energie der leeren Ligand-π*-Orbitale im Vergleich zu den besetzten Ligand-p-Orbitalen bei den π-Basen. Bei der Wechselwirkung mit den drei Metall-t2g-Orbitalen wird das vorher nichtbindende Niveau bindend, so dass die Metall-t2g-Orbitale stabilisiert werden. Das Schema zeigt als Folge eine Vergrößerung von 10 Dq:
Die Bedeutung der einzelnen Wechselwirkungen ist in der Literatur für den Cyanido-Ligand umstritten. Während bei CO- und NO+-Liganden die π-Acidität allgemein als bestimmend für deren Chemie angesehen wird, werden Sie über CN− widersprüchliche Angaben finden. Es herrscht weitgehend Einigkeit, dass man über die oben erwähnte π-Basizität nachdenken sollte (der Wechselwirkung zwischen leeren Metall-t2g- und den besetzten 1π-Orbitalen), diese aber letztlich nicht bestimmend für die Eigenschaften des Cyanido-Liganden ist. Unterschiedlich aber wird die Bedeutung von σ-Basizität und π-Acidität bewertet. So wird zum einen die ähnliche Energie von Cyanid-HOMOs und den Grenzorbitalen des Metalls hervorgehoben – also die Kovalenz der M–C-Bindung betrachtet –, andere Autoren heben dagegen die Analogie zu CO und NO+ also die Bedeutung der π-Acidität auch für CN− hervor. In diesem Text wird vorsichtshalber nur bei CO- und NO+-Liganden mit deren π-Acidität argumentiert.
Wird über derartige Unstimmigkeiten hinweggesehen, so gibt die spektrochemische Reihe im Wesentlichen das π-Bindungsverhalten der Liganden wieder. Während alle Liganden σ-Basen sind, erzeugen sie eine zunehmend höhere Feldaufspaltung in der Reihe ihrer π-Wechselwirkungen:
Aus Konzepten wie der Kristallfeldaufspaltung, der LFSE und MO-Schemata lassen sich Regeln ableiten, die eine Vorhersage erlauben, wie sich die verschiedenen Zentralmetalle und Liganden zu Komplexen zusammenlagern.
Die Regel, dass im starken Feld die höchstliegenden, antibindenden Zustände unbesetzt bleiben, erklärt die große Bedeutung quadratisch-planarer Komplexe mit d8-Zentralmetallen. Ist die Kristallfeldaufspaltung hinreichend groß – dies trifft für die 4d- und 5d-Elemente mit ihren großen gM-Werten bei allen Liganden zu – liegen quadratisch-planare Komplexe vor wie zum Beispiel bei [Pd(NH3)4]2+, [PtCl4]2− oder [AuCl4]−. In der ersten Übergangsreihe bilden CoI und CuIII nur mit speziellen Liganden Komplexe und werden hier nicht näher betrachtet; NiII benötigt mit seinem nicht so großen Wert für gM einen Starkfeldliganden wie das Anion von Diacetyldioxim (dmg). Liegen diese Voraussetzungen vor, ist das x2−y2-Orbital gegenüber den übrigen vier Orbitalen deutlich destabilisiert, so dass es günstig ist, die vier energetisch tiefer liegenden Orbitale zu besetzen und das eine hochliegende frei zu lassen – daher d8. Man beachte, dass in der folgenden Liste der d8-Zentralmetalle zahlreiche wichtige Katalysemetalle vorkommen. Sie werden lernen, dass die Möglichkeit, neben dem Oktaeder eine energetisch günstige niederkoordinierte Form zur Verfügung zu haben, Voraussetzung für den Ablauf von Katalysecyclen ist, in denen keine „thermodynamische Fallen“ vorkommen. Hierunter versteht man zum Beispiel Komplexe, in denen Edukte oder Produkte so stabile Komplexe mit einem Zentralmetall eingehen, dass ihre Entfernung viel Energie verschlingt, so dass kaum noch Reaktivität vorliegt.
| 9 | 10 | 11 | |
|---|---|---|---|
| 3d | NiII | CuIII | |
| 4d | RhI | PdII | AgIII |
| 5d | IrI | PtII | AuIII |
Ein quadratisch-planarer Komplex, der große praktische Bedeutung erlangt hat, trägt den internationalen Freinamen Cisplatin. Es handelt sich um cis-Diammin-dichlorido-platin(II). Dieser inerte d8-Komplex ist eines der wichtigsten Krebstherapeutika, mit dem manche Tumorarten zu beinahe 100 % geheilt werden können. Auf die Synthese von Cisplatin wird weiter unten im Abschnitt über den trans-Effekt eingegangen.
Die Wirkung von Cisplatin erschließt sich aus einer Röntgenstrukturanalyse, welche die Wechselwirkung eines verwandten Platin(II)-Fragments, nämlich Ammin-cyclohexanamin-platin(II), mit einem DNA-Fragment zeigt (Quelle: Eintrag 1LU5 der Protein-Datenbank; Einzelheiten, Links, etc. siehe Vorspann zur Vorlesung „Bioanorganische Chemie“; Farbcodierung der Atome: C grün, N blau, O rot, Pt und P violett, H-Atome sind weggelassen):
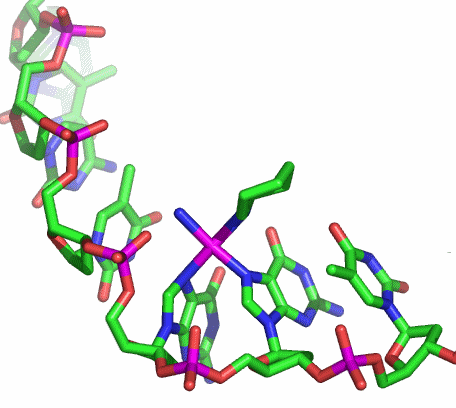
Dargestellt ist ein Einzelstrangabschnitt eines doppelsträngigen DNA-Fragments. Der zweite Strang ist der Übersichtlichkeit halber weggelassen – dies schadet nicht dem Verständnis, da die Wasserstoffbrückenbindungen zwischen den Strängen im Bereich der Platinbindungsstelle ohnehin aufgehoben sind und der zweite Strang weggeschoben ist. Das Platin(II)-Zentralatom ist quadratisch-planar von einem Ammin-, einem Cyclohexanamin- (der Cyclohexansessel ist von der Seite zu sehen) und zwei Guanin-Liganden koordiniert. Die beiden Guanin-Liganden, welche die Chlorido-Liganden des Cisplatins substituiert haben, liegen im DNA-Strang nebeneinander. Durch die Koordination an das PtII-Zentrum entsteht ein deutlich sichtbarer Knick im DNA-Strang. Durch die Aufhebung des Doppelstrangs, die Koordination des Platin(II)-Zentralatoms mit seinen weiteren Liganden und die Abknickung wird die DNA so weit verändert, dass DNA-ablesende Enzyme – auch Reparaturenzyme – nicht mehr die modifizierte DNA ablesen können. Das weitere Wachstum der Zelle wird so verhindert, was bei einer Tumorzelle das Therapieziel ist.
Aus der Strukturanalyse ist ersichtlich, dass die Bindung des Platins an N7 des Guanins erfolgt. Wir diskutieren, warum N7 der beste Ligand ist und fragen danach, ob das freie Elektronenpaar an den einzelnen Stickstoffatomen gleichermaßen für die Bindung eines Zentralmetalls zur Verfügung stehen, oder ob es durch andere Wechselwirkungen beansprucht ist (beachte mesomere Grenzstrukturen von N-Atomen in Amiden und vinylogen Amiden).
Während für quadratisch-planare Komplexe große Unterschiede bei den d-Orbitalenergien typisch ist, treten tetraedrische Komplexe meist dann auf, wenn die Ligandfeldstabilisierung nur klein ist. Ein häufiger Fall: Die LFSE ist für alle möglichen dn-Konfigurationen deshalb klein, weil aufgrund kleiner Werte für gM und fL 10 Dq klein ist. Kleine gM-Werte liegen bei den zweiwertigen Metallen der ersten Übergangsreihe vor, kleine fL-Werte bei den π-basischen Liganden in der linken Hälfte der spektrochemischen Reihe. (Jahn-Teller-verzerrte) tetraedrische Komplex-Ionen wie [FeIICl4]2− und zahlreiche weitere Tetrahalogenido-metallate(II) gehören in diese Gruppe. Koordinationstetraeder werden aber auch bei größerem gM oder fL gefunden, wenn keine LFSE auftritt: [FeIIICl4]− (high-spin-d5) und [AlIII(OH)4]− sind Beispiele, natürlich auch die zahlreichen Oxidometallate mit dem Zentralmetall in der höchsten Oxidationsstufe, also in weiteren d0-Komplexen: VO43−, CrO42−, MnO4−. Ebenso wie bei den d0-Ionen spielt auch bei der d10-Konfiguration die nun abgeschlossene d-Unterschale keine aktive Rolle in der Chemie dieser Zentralmetalle. Die Bindungsmöglichkeiten eines Zentralmetalls wie Kupfer(I) oder Zink(II) werden im Sinne einer sp3-Hybridisierung vielmehr von den s- und p-Orbitalen der Valenzschale bestimmt – wenn auf der Seite der Liganden eine hinreichende Neigung zu kovalenten Wechselwirkungen vorliegt. Der tetraedrische Bau von Tetracyanido-cuprat(I), Tetracyanido-zincat, -cadmat und mercurat, [Zn(CN)4]2−, [Cd(CN)4]2−, und [Hg(CN)4]2−, belegt diese Regel – die natürlich auch in Komplexen kleiner Hauptgruppenelemente wirkt, die durch sp3-Hybridisierung gekennzeichnet sind: BeF42− und BF4− gehören unbestreitbar hierzu, während Hauptgruppenanaloga zu Tetraoxidometallaten wie CrO42− und MnO4− – SO42− und ClO4− – in der Regel nicht mehr als Komplex-Ionen eingeordnet werden (nicht zu unrecht, da die charakteristischen Reaktionen der Komplexchemie wie zum Beispiel der Ligandaustausch hier untypisch sind).
Bei ionischeren Komplexen wie den Tetrachlorido-metallaten(II) ist es näher liegend, nicht mit der Hybridisierung, sondern mit der Größe und vor allem der Ladung der Liganden zu argumentieren. Warum reagiert Salzsäure mit blassvioletter [Co(H2O)6]2+-Lösung zum tiefblauen [CoCl4]2− anstatt ein oktaedrisches Hexachloridocobaltat zu bilden? Sechs große Chlorido-Liganden könnten für ein Cobalt(II)-Ion eine sterische Überfrachtung darzustellen – andererseits gibt es das [PCl6]−-Ion mit dem sehr viel kleineren Phosphoratom. Wichtiger als sterische Einflüsse ist offensichtlich die elektrostatische Balance: mit anionischen Liganden würde in einem oktaedrischen Metallat(II) gemäß [MIIX6]4− die Abstoßung der sechs Anionen nur durch ein zweiwertiges Kation ausgeglichen. Der mit der Ladung 4− recht hoch geladene Komplex würde durch die nicht-kompensierte Abstoßung zwischen den Liganden destabilisiert. Beispiele, dass eine ausgeglichene Elektrostatik und weniger gerichtete Bindungen bestimmend sein können, werden bei den Halogenidometallaten(II) mit größeren Zentralmetallen gefunden: so lässt sich im System Cadmium(II)/Chlorid sowohl [CdCl4]2− als auch [CdCl5]3− isolieren, während [CdCl6]4− keine Bedeutung hat.
Fünffachkoordination tritt jedoch nicht nur als Folge elektrostatischer Balance auf, sondern auch als Folge elektronischer Verhältnisse in der d-Unterschale: Nach der Reaktion von Nickel(II) mit Cyanid lassen sich Nickelate mit quadratisch-planarem Tetracyanido-nickelat(II)-Anion, [Ni(CN)4]2−, isolieren, aber auch trigonal-bipyramidales oder quadratisch-pyramidales Pentacyanido-nickelat(II), [Ni(CN)5]3− – jedoch kein oktaedrisches Hexacyanido-nickelat(II), [Ni(CN)6]4−, was auf den ersten Blick als wahrscheinlichste Spezies hätte erscheinen können. Bei [Ni(CN)6]4− jedoch sind 20 Elektronen in das MO-Schema einzufüllen (12 Ligand-Elektronen + 8 Metall-Elektronen). Wegen des bei Cyanido-Komplexen großen Wertes für 10 Dq lägen also zwei Elektronen in einem stark antibindenden Orbital vor. Gegenüber diesem ungünstigen Fall ist [Ni(CN)5]3− ein 18e-Komplex und [Ni(CN)4]2− ist der beschriebene d8-Sonderfall – beides sind konkurrenzfähige Bindungssituationen, die auch tatsächlich gefunden werden.
Für Komplexe der Koordinationzahl 5 werden zwei ungefähr energiegleiche Strukturen beobachtet: Die quadratische Pyramide, bei der sich eine axiale Position (im Bild die nach oben weisende Bindung) von vier äquatorialen Positionen unterscheidet, und die trigonale Bipyramide. Hier sind zwei axiale Liganden (im Bild vor und hinter dem Zentralmetall) von drei äquatorialen zu unterscheiden. Das Bild ist so gezeichnet, dass die strukturelle Ähnlichkeit der beiden Formen betont wird; es sind nur kleine Verschiebungen der jeweils vier nicht nach oben weisenden Liganden nötig, um die eine Form in die andere zu überführen („Berry-Pseudorotation“).
Die Koordinationszahl 5 ist weniger häufig als die Koordinationszahl 6. Oft liegt wie im Beispiel der Cyanidonickelate ein konkreter elektronischer Grund für diese Struktur vor.
Die mit Abstand wichtigste Koordinationsfigur in der Komplexchemie ist das Oktaeder. Kristallfeldaufspaltung und LFSE sind hier maximal. Da darüberhinaus die Größenverhältnisse zwischen den meisten Liganden und Zentralatomen diese Anordnung auch für nicht-kristallfeldstabilisierte Komplexe erlauben, tritt sie so häufig auf, dass es sinnvoll ist, die wichtigsten Ligandtypen daraufhin zu untersuchen, wann keine oktaedrischen Komplexe zu erwarten sind.
Wegen der elektrostatischen Einschränkung bei den [MIIX6]4−-Ionen und wegen der Größe von Chlorido-, Bromido- und Iodido-Liganden kommen Koordinationsoktaeder vor allem mit Fluorido-Liganden vor. Das beim Maskieren von Eisen(III) mit Fluorid gebildete [FeIIIF6]3− ist ebenso ein Beispiel wie das aus der Analyse bekannte Hexafluorido-silicat [SiF6]2− oder das in der präparativen Chemie oft als Gegenion benutzte [PF6]−. [CoIIIF6]3− ist einer der seltenen high-spin-Cobalt(III)-Komplexe. MIIF6-Oktaeder kommen in Salzen vor, die vierfach koordinierte Metalle zu enthalten scheinen. K2NiF4 ist ein Beispiel. Entsprechend der Formulierung K2[NiF2F4/2] verbrücken die Hälfte der Fluorido-Liganden jeweils zwei oktaedrisch koordinierte Nickel-Zentralatome. Da dies an vier Positionen der NiF6-Oktaeder geschieht, liegen ausgedehnte Schichten eckenverknüpfter Oktaeder vor. Man beachte, dass durch die Verbrückung von Kationen durch Anionen die elektrostatisch ungünstige Bindungssituation eines [MIIX6]4−-Einkernkomplexes umgangen wird.
Fluorido- und Hydroxido-Liganden sind einander sehr ähnlich. Trotzdem sind Hydroxido-Komplexe mit weniger Zentralmetallen bekannt. Beispiele aus der ersten Übergangsreihe sind [Cu(OH)4]2−, zu dem sich Kupfer(II)-hydroxid bei sehr hoher OH−-Konzentration auflöst, bei den MII-Zentralmetallen, und [Cr(OH)6]3− bei den dreiwertigen Metallen. Ist die Lewis-Acidität eines Zentralelements hoch, so stabilisiert dies nicht den Hydroxidokomplex, sondern es entstehen Oxido-Komplexe mit kleinerer Koordinationszahl. So scheint ein dem [PF6]− analoges, oktaedrisches [P(OH)6]− nicht zu existieren, sondern nur das formal durch Abspaltung von 2 Wassermolekülen gebildete tetraedrische [P(OH)2O2]− = H2PO4− (Dihydrogenphosphat). Bei den Übergangsmetallen wird die seltsame Beobachtung gemacht, dass Oxido- und Aqua-Liganden nebeneinander vorkommen anstatt dass sich unter Protonenverschiebung zwei Hydroxido-Liganden bilden. Dieses vor allem in der zweiten und dritten Übergangsreihe häufige Phänomen tritt unter den 3d-Elementen zum Beipiel bei Vanadium(IV) auf, wo es einen gemischten Oxido-aqua-Komplex gibt, bei dem die Aqua-Liganden, nicht aber der Oxido-Ligand, leicht ausgetauscht werden können. Dieses „Vanadyl“-Ion genannte Pentaaqua-oxido-vanadium(IV)-Dikation zeigt viele der inzwischen entwickelten Prinzipien besonders klar. Wir betrachten es daher näher.
Eine geläufige Darstellung des Vanadyl-Ions sieht so aus:
Die Formulierung beachtet die übliche Zweibindigkeit eines Sauerstoffatoms und lenkt damit vom ungewöhnlich kurzen V-O-Abstand ab. Während nämlich typische 3d-Element-Sauerstoff-Abstände ca. 2 Å betragen, liegt der V-O-Abstand im Vanadyl-Fragment unter 1.6 Å und kommt damit in die Nähe einer C-C-Bindung (1.54 Å). Konkrete Werte werden in Kristallstrukturanalysen gefunden, sie ergeben sich auch aus Rechnungen am isolierten Ion. Bei der im Folgenden genutzten Rechnung ergibt sich: V-OOxido 1.591, Mittelwert V-Ocis-Aqua 2.055, V-Otrans-Aqua 2.200 Å.
Das Vanadyl-Ion weist mit dem Oxido-Ligand einen besonders starken π-Donor-Ligand auf. Wählen wir die V-OOxido-Achse als z-Richtung, lassen sich zwei π-Wechselwirkungen benennen: das p(x)-Elektronenpaar des Sauerstoffs bindet in das leere d(xz)-Orbital des Vanadiums, und das Sauerstoff-p(y)-Elektronenpaar bindet in das leere Metall-d(yz)-Orbital. Hinzu kommt eine σ-Donorbindung von einem p(z)-Elektronenpaar des Sauerstoffs (möglicherweise mit s-Anteil) in das leere Vanadium-d(z2)-Orbital. Ähnlich wie es bei der Diskussion der LFSE anschaulich gemacht wurde, findet das einzelne d-Elektron dort Platz, wo es die geringste Abstoßung erfährt, hier im d(xy)-Orbital des Zentralmetalls.
Ein Blick auf die computerchemische Behandlung veranschaulicht diese Überlegungen. Das α-HOMO hat fast reinen Metallcharakter, es entspricht weitgehend dem d(xy)-Atomorbital des Zentralmetalls (beachten Sie, dass der sichtbare kleine Anteil von zwei äquatorialen Aqualiganden den oben abgeleiteten Regeln entspricht: im Bereich der Grenzorbitale erwarten wir eine Modifizierung von Metall-d-Orbitalen des Typs xy, xz, yz durch π-Antibindungen; das MO 40a zeigt eine solche mit der schwachen π-Base Wasser):
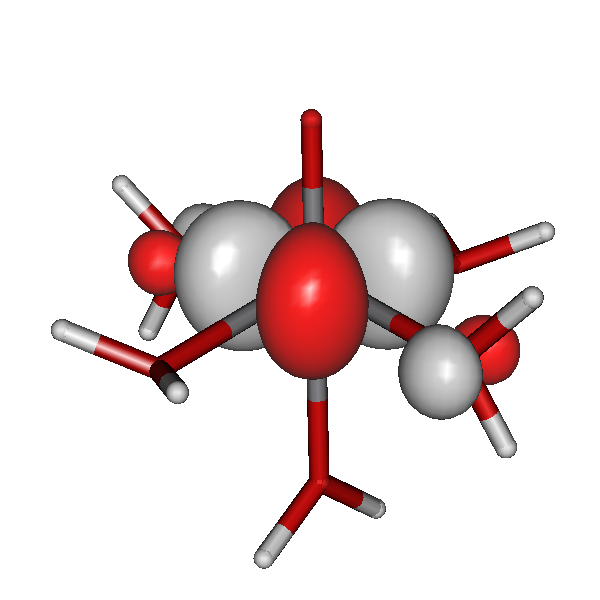
Das energiereichste α-Spin-Orbital 40a des d1-Ions [VO(H2O)5]2+ mit überwiegendem V(3d-xy)-Charakter (technische Anmerkung: bp/tzvp, isovalue 0.06)
Die π-Donorbindungen finden sich bei niedrigeren Energiewerten. Die beiden folgenden Orbitaldarstellungen zeigen die entsprechenden, nicht besetzten Antibindungen, das LUMO und das LUMO+1 (die Darstellung antibindender Wechselwirkungen ist in der Literatur zur Illustration von MOs verbreitet, da sie die beteiligten Atomorbitale durch die zusätzliche Knotenebene deutlich hervortreten lassen).
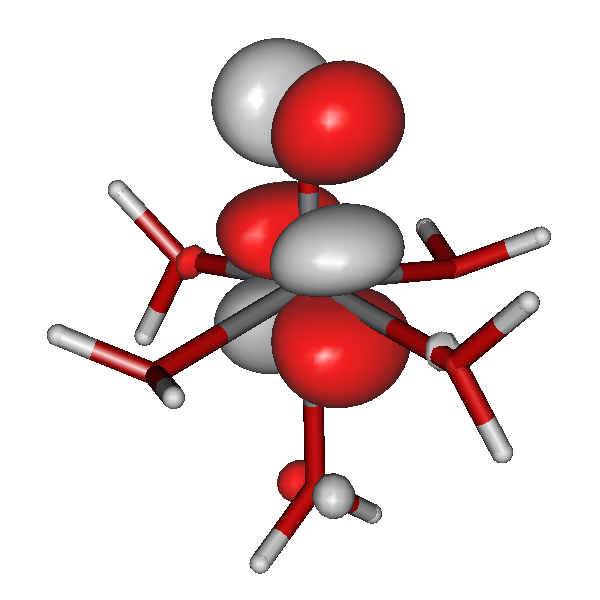
Das leere, d(xz)-p(x)-π-antibindende Orbital 41a
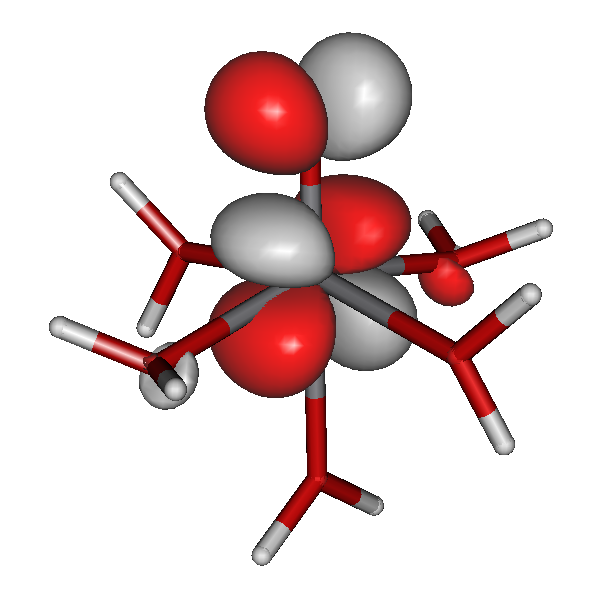
Das leere, d(yz)-p(y)-π-antibindende Orbital 42a
Die Analyse ergibt für das d1-Vanadium(IV)-Zentrum als Ausgangspunkt eine hohe Lewis-Acidität aufgrund der hohen Oxidationsstufe. Es kommt zur Deprotonierung von Aqualiganden. Durch das einzelne d-Elektron ergeben sich zwei Akzeptororbitale für π-Bindungen, denen nur ein Oxido-Ligand (und nicht zwei Hydroxido-Liganden) zwei π-Donororbitale anbieten kann. Das einzelne d-Elektron weicht diesen π-Elektronenpaaren aus und erlaubt dadurch dem Oxidoligand eine ungewöhnliche Annäherung – ganz, wie wir es bei der LFSE-Betrachtung kennengelernt hatten. In der Summe ergibt sich eine σ-Donor- und zwei π-Donorbindungen, die dem Vanadyl-Fragment eine ungewöhnliche Stabilität geben. Dementsprechend hat eine alternative Formulierung ihre Berechtigung (ohne Formalladungen):
Das Vanadyl-Ion ist kein Einzelfall. Weitere Beispiele für Oxidometall-Dreifachbindungen finden sich bei den Elementen der zweiten und dritten Übergangsreihe. Solche Oxidometall-Fragmente haben große Bedeutung in der katalytischen Übertragung von Sauerstoffatomen. Dies gilt für Oxidovanadium-Spezies (Kontaktverfahren) ebenso wie für Molybdän-, Wolfram- und Rhenium-Analoge, ein Beispiel ist das sehr stabile {ReVO}3+-Fragment.
Die von Aqua-Liganden erzeugte Kristallfeldaufspaltung ist in der Regel nicht so stark, dass in der ersten Übergangsreihe low-spin-Komplexe gebildet werden. Eine bemerkenswerte Ausnahme ist das d6-Ion [CoIII(H2O)6]3+. Oktaedrische Hexaaqua-Komplexe sind mit den meisten zwei- und dreiwertigen Metallen bekannt. Je stärker die Lewis-Acidität des Zentralmetalls, umso saurer muss eine Lösung sein, um einen nicht-deprotonierten Aquakomplex vorzufinden. Aquakomplexe vierwertiger Zentralmetalle – siehe das Vanadium(IV)-Beispiel – sind in der Regel zu sauer als dass alle Liganden Wasser sein könnten. Man beachte auch hier die Trends im Periodensystem: Hexaaqua-aluminium(III)-Ionen, [AlIII(H2O)6]3+, können zum Beispiel im Alaun, KAl(SO4)2 · 12 H2O isoliert werden, ein isoelektronisches [SiIV(H2O)6]4+-Ion ist nicht bekannt; vielmehr verbleibt auch nach Abspaltung von vier Protonen (und zwei Wassermolekülen) aus diesem hypothetischen Komplex mit [Si(OH)4] = H4SiO4 (Kieselsäure) immer noch eine saure Spezies.
Die günstige Stellung des reinen σ-Donor-Liganden NH3 in der spektrochemischen Reihe führt dazu, dass sich Ammin-Liganden in einer wässrigen Lösung immer dann gegen Aqua- und Hydroxido-Liganden behaupten können, wenn die LFSE wegen des höheren Wertes von 10 Dq zum Tragen kommt. Fehlt dagegen eine LFSE, fehlen in der Regel auch stabile Ammin-Komplexe, in einer wässrigen Lösung fällt dann meist das entsprechende Hydroxid. Beispiele bei Paaren ähnlicher Zentralmetalle:
• [Ni(NH3)6]2+ und [Co(NH3)6]2+ sind stabile Komplexe (LFSE = −12 und −8 Dq), [Fe(NH3)6]2+ entsteht im Wässrigen nur bei sehr hoher NH3-Konzentration, man isoliert das Ion am Besten aus flüssigem Ammoniak (LFSE = −4 Dq), MnII bildet in wässriger Lösung keinen Amminkomplex (LFSE = 0), [Mn(NH3)6]2+ wurde ausschließlich aus flüssigem Ammoniak isoliert.
• [Co(NH3)6]3+ ist ein stabiler und inerter low-spin-Komplex (LFSE = −24 Dq), stabil und inert ist auch [Cr(NH3)6]3+ (LFSE = −12 Dq), Eisen(III) jedoch bildet im Wässrigen keinen Amminkomplex (LFSE = 0 für hs-FeIII, für ls-FeIII reicht offenbar die Feldaufspaltung nicht).
Ohne d-Elektron-Beteiligung treten Amminkomplexe nur selten auf. Beispiele sind [Cu(NH3)n]+ und [Ag(NH3)2]+. Weitere Komplexe sind mit d10-Zentralmetallen wie Zink und Cadmium bekannt, wo Metall- und Ligand-Orbitale im Sinne erhöhter kovalenter Anteile energetisch zusammenpassen. In der isoelektronischen Reihe CuI, ZnII, GaIII treten schon bei Gallium keine Amminkomplexe mehr auf; generell sind Komplexe mit NH3 oder Aminen in der Hauptgruppenchemie (LFSE = 0) ohne Bedeutung.
Aufgrund ihrer Stellung in der spektrochemischen Reihe bilden Cyanido-Liganden mit MII- und MIII-d4–d7-Zentren low-spin-Komplexe – wobei auch ein Zentralmetall wie Mangan(II) in [MnII(CN)6]4− im low-spin-Zustand vorliegt, obwohl hier ansonsten fast nur high-spin-Komplexe gefunden werden. Wie am System NiII/CN− dargestellt, wird die Besetzung antibindender eg*-Orbitale vermieden. So ist das Cyanido-cobaltat(II) nicht oktaedrisch (19 Elektronen), sondern das d7-Zentrum Cobalt(II) bildet ein [CoII(CN)5]3−. Die Bildungstendenz des d6-konfigurierten 18-Elektronen-Komplexes [CoIII(CN)6]3− ist dabei so hoch, dass wässrige Lösungen von Cyanidocobaltat(II) beim Erhitzen unter H2-Entwicklung in die dreiwertige Form übergehen. Cyanido-Liganden haben mit Ammin-Liganden gemeinsam, dass d10-Zentralmetalle der Gruppen 11 und 12, also Kupfer(I), Silber(I) und Gold(I) sowie Zink, Cadmium und Quecksilber(II), stabile Komplexe bilden, die durch kovalente Bindungen geprägt sind, dass aber bei den Hauptgruppenelementen Cyanidokomplexe keine nennenswerte Rolle spielen.
Zweifach-Koordination wird hauptsächlich bei der einwertigen Stufe der Elemente der 11. Gruppe (Cu, Ag, Au) und bei Quecksilber(II) gefunden. Beispiele sind [CuICl2]−, [AgI(NH3)2]+, [AuI(CN)2]−, [HgII(CN)2]. Alle Zentralmetalle sind d10-konfiguriert, so dass die d-Unterschale als unbeteiligt an den Metall-Ligand-Bindungen angesehen wird. Den Zentralmetallen kann eine sp-Hybridisierung zugeschrieben werden und so eine nennenswerte Kovalenz der Metall-Ligand-Bindungen betont werden. Man beachte zum Beispiel, dass das gut lösliche Quecksilber(II)-cyanid keine typischen Nachweisreaktionen des hydratisierten Quecksilber(II)-Ions zeigt (zum Beispiel die Reaktion mit Sulfid zu schwerlöslichem HgS), da diese kovalente Verbindung nicht mehr nennenswert dissoziiert. Es sollte beachtet werden, dass sich die Zweifach-Koordination nicht wie bei den bisher besprochenen Komplexen aus nachvollziehbaren Regeln heraus plausibel machen lässt, sondern als ein etwas eigenartiger Fall dasteht.
Es wäre falsch zu glauben, dass einfach zusammengesetzte Komplexe immer auch besonders leicht vorhersehbare Strukturen aufweisen. Oft ist nicht klar ersichtlich, welcher der vorliegenden Effekte das größere Gewicht hat. Welche einzelnen Einflussgrößen aber überhaupt zu erwarten sind, sollte man sich klarmachen: In salzsauren Kupfer(II)-Lösungen liegen Chloridocuprate(II) wie [CuCl5]3− und [CuCl4]2− vor. Welche Struktur könnte die vierfach koordinierte Form haben? Kupfer(II) trägt als zweiwertiges Zentralmetall der ersten Übergangsreihe nicht zu einer hohen Feldaufspaltung bei. Da dies durch die Chlorido-Liganden nicht ausgeglichen wird, ist eine kleine Feldaufspaltung zu erwarten. Die kleine Feldaufspaltung wirkt sich auf eine ohnehin kleine LFSE aus (Oktaeder: −6 Dq, Tetraeder: −4 Dq). Das Kupfer(II)-Zentrum hat 9 d-Elektronen. In einem quadratisch-planaren Komplex wäre das höchstliegende, antibindende Orbital einfach besetzt, die Verhältnisse sind also nicht so klar wie in einem d8-Fall bei starkem Feld. Alles in allem: mit den recht großen Chlorido-Liganden wäre ein CuCl4-Tetraeder insgesamt plausibel, der aber eine Jahn-Teller-Verzerrung aufweisen sollte:
Es lassen sich drei energetisch entartete Zustände formulieren, die sich durch die Elektronenanordnung im höherliegenden t2-Zustand unterscheiden. Wie bei der high-spin-d4- und der d9-Konfiguration in oktaedrischer Koordination liegt also eine Jahn-Teller-Situation in den höherliegenden Orbitalen vor, so dass die erwartete Verzerrung des Tetraeders deutlich sein sollte. Wie also sieht Tetrachloridocuprat(II) aus? Das Experiment und quantenchemische Berechnungen zeigen einen geringen Energieunterschied auf dem gesamten Weg zwischen einem tetraedrischen und einem quadratisch-planaren Komplex. Vor diesem Hintergrund werden sekundäre Wechselwirkungen entscheidend wie Bindungen zu den Gegenionen, Wasserstoffbrückenbindungen und Kristallpackungseffekte. So werden Salze gefunden, in denen eine fast reguläre Tetraedergestalt realisiert ist, aber auch eine unverzerrte quadratisch-planare Umgebung kommt vor, die bei Berechnungen am freien Anion als nur schwach unstabiler Übergangszustand erscheint.
Bei den verschiedenen Strukturen und Koordinationszahlen, die in der letzten Lehreinheit zusammengestellt sind, können in Abhängigkeit vom Formeltyp in vielfältiger Weise Isomere formuliert werden. Sind die Komplexe inert in Bezug auf Ligandsubstitutionsreaktionen, können solche Isomere auch isoliert werden, manchmal können sie auch gezielt hergestellt werden.
In oktaedrischen Komplexen kommt bei den Zusammensetzungen ML6 und ML5L' nur eine Form vor. In Komplexen des Formeltyps ML4L'2 können die beiden L'-Liganden cis oder trans zueinander stehen. Bei der Formel ML3L'3 können sowohl die L- als auch die L'-Liganden entweder facial („fac“) oder meridional („mer“) angeordnet sein. Neben diesen bereits erwähnten Isomeriearten besonders interessant ist die Bildung optischer Isomere („Enantiomere“), die sich zueinander wie Bild und Spiegelbild verhalten. Dieser Komplextyp tritt vor allem dann auf, wenn drei zweizähnige Liganden wie Oxalat (ox), Ethylendiamin (en), 2,2'-Bipyridin (bpy) oder Phenanthrolin (phen) in oktaedrischer Koordination vorliegen. Das folgende Bild zeigt diese Art der Isomerie am Beispiel des Tris(oxalato)chromat(III)-Ions. Das Ion ist durch die dreizählige Symmetrieachse projiziert.
Auf der rechten Seite der Abbildung ist die Ligandanordnung stilisiert wiedergegeben, so dass klarer wird, dass dieses Objekt eine Schraube darstellt. Es ist von seinem Spiegelbild, das in anderer Farbe dargestellt ist, verschieden, es ist chiral. Will man die Schraube in die Papierebene hineindrehen, so muss im Uhrzeigersinn gedreht werden. Man nennt diese Form das Δ-Enantiomer (von lat. dexter rechts, dessen erster Buchstabe durch den entsprechenden griechischen Großbuchstaben dargestellt wird). Dieses Δ-Tris(oxalato)chromat(III) lässt nicht durch irgendwelche Drehbewegungen in das Λ-Isomer (lat. laevus links) überführen. Enantiomere können durch geeignete Trennoperationen isoliert werden. Nach der Umsetzung von Chrom(III)-Salzen mit Oxalat entstehen die beiden (energiegleichen) Enantiomere natürlich in derselben Menge, es bildet sich ein Racemat, in einer Formel schreibt man rac-Tris(oxalato)chromat(III).
Chirale Komplexe können wie alle farbigen chiralen Verbindungen durch CD-Spektroskopie untersucht werden (CD = Circular-Dichroismus). Die Methode beruht darauf, dass die Absorption eines chiralen Chromophors geringfügig variiert, je nachdem ob rechts- oder links-circularpolarisiertes Licht durch das Material hindurchtritt („Cotton-Effekt“). Die CD-Spektroskopie ist für die Untersuchung biologischer Proben außerordentlich nützlich. Man beachte nämlich, dass ein Metallkomplex nicht nur dann chiral ist, wenn die beschriebene besondere Situation am Oktaeder auftritt und die Enantiomere getrennt werden können. Vielmehr ist jeder Komplex chiral, der mit einem chiralen Liganden gebildet wird – zum Beipiel einem Kohlenhydrat, einer Aminosäure, einem Peptid oder Protein, einem Nucleosid. Der besondere Wert der Methode liegt auch in den Auswahlregeln, die andere sind als bei der UV/Vis-Spektroskopie. Ohne hier ins Detail zu gehen sei erwähnt, dass die in der Komplexchemie besonders interessierenden elektronischen Übergänge innerhalb der d-Unterschale des Metalls hier nicht verboten sind und zu deutlich sichtbaren Banden führt.
Der praktisch bedeutendste Fall von Isomerie bei quadratisch-planaren Komplexen wird bei der Zusammensetzung ML2L'2 gefunden. Die jeweils gleichen Liganden können hier entweder cis oder trans zueinander angeordnet sein. Das bereits erwähnte Krebstherapeutikum Cisplatin, cis-Diammin-dichlorido-platin(II), ist ein Beispiel für einen inerten Komplex, der sich von seinem trans-Isomer trennen lässt und der sich auch bei monatelanger Lagerung von Infusionslösungen nicht in das trans-Isomer umlagert. Das trans-Isomer ist darüberhinaus in der Tumorbehandlung unwirksam. Cisplatin ist ein Beispiel für ein Komplexisomer, das sich gezielt herstellen lässt. Die selektive Synthese ist generell eine wichtige Forderung in der Wirkstoffsynthese, bei der es in der Regel nicht akzeptabel ist, ein Isomerengemisch herzustellen, das gewünschte Isomer abzutrennen und die nicht erwünschten zu entsorgen. Grundlage für die selektive Synthese von Cisplatin ist der „trans-Effekt“, der lange vor der Entwicklung von Modellvorstellungen wie der Kristallfeldtheorie oder der MO-Theorie entdeckt wurde. So war aufgefallen, dass Liganden in der Reihenfolge
NH3 < Cl− < Br− < I− < CN−
zunehmend stärker in der Lage sind, unter den Bedingungen einer Ligandsubstitutionsreaktion den zu ihnen trans-ständigen Ligand zum Austausch zu bewegen. Der gegenüber Ammoniak größere trans-Effekt des Chlorido-Liganden wird wirksam, wenn das quadratisch-planare Tetrachlorido-platinat(II) mit zwei Äquivalenten Ammoniak umgesetzt wird:
Die Substitution des zweiten Chlorido-Liganden findet demnach trans zu einem Chlorido-Ligand, aber nicht trans zum Ammin-Ligand statt. Spielt man nun die verschiedenen Möglichkeiten durch, so wird stets das cis-Diammin-Isomer als einzige Diammin-dichlorido-Form erhalten. Man mache sich klar, dass die Umsetzung des Tetraamminplatin(II)-Ions mit zwei Äquivalenten HCl zu trans-Diammin-dichlorido-platin(II) führt (da Ammin-platin(II)-Komplexe stabiler als Chlorido-Komplexe sind, genügt die Umsetzung mit Cl− nicht; durch HCl als Reaktand wird daher sowohl der Chlorido-Ligand zur Verfügung gestellt als auch wird NH3 als NH4+ gebunden).
Die Reaktivität von Komplexverbindungen war bisher nur unter dem Aspekt der Metall-Ligand-Wechselwirkung betrachtet worden. So wurde das Mengenverhältnis zwischen Komplex und den freien Bestandteilen als Komplexbildungskonstante formuliert und damit die Thermodynamik der Komplexbildung beschrieben, während kinetische Betrachtungen sich auf Ligandaustauschreaktionen beschränkten, indem inerte von labilen Komplexen unterschieden wurden. Neben Säure-Base-Reaktionen, zu denen Bildung, Zerfall und Ligandaustausch von Komplexen nach dem Konzept von Lewis gehören, bilden Redox-Reaktionen den zweiten wichtigen Reaktionstyp in der Chemie.
Bei der Messung des Standardpotentials von Redoxpaaren wie Cu/Cu2+ oder Fe2+/Fe3+ werden Standardbedingungen eingestellt. In saurer Lösung sind dies die typischen Bedingungen, die zu Aquakomplexen führen. Das Standardpotential von +0.77 V für das Eisen(II,III)-Potential beschreibt also die Gleichgewichtslage der Halbreaktion
[FeII(H2O)6]2+ ⇄ [FeIII(H2O)6]3+ + e−
im Vergleich zur Standardwasserstoffelektrode. Da Zentralmetalle verschiedener Oxidationsstufe mit den zur Verfügung stehenden Liganden verschieden stabile Komplexe ausbilden, darf erwartet werden, dass Redoxpotentiale von der Anwesenheit von Liganden abhängen. Bildet nur eine der beiden Oxidationsstufen des Redoxpaares einen stabilen Komplex, so kann die Auswirkung auf das Potential abgeschätzt werden. So beträgt das Standardpotential des Cu/Cu2+-Paares +0.34 V. Man stelle sich vor, dass der Halbzelle so viel Ammoniak zugegeben wird, dass als Hauptspezies im Lösungsgleichgewicht der stabile Tetraamminkupfer(II)-Komplex entsteht. Ammoniak ist kein Ligand, bei dem eine Reaktion mit der reduzierten Form im Redoxpaar, Kupfer(0), zu erwarten ist. Es bleibt also als einzige Veränderung die Umwandlung des Aquakupfer(II)-Ions bei Standardbedingungen in den stabilen Amminkupfer(II)-Komplex. Die Komplexbildungskonstante lgβ14 = 12 zeigt, dass das Gleichgewicht
[Cu(H2O)6]2+ + 4 NH3 ⇄ [Cu(NH3)4(H2O)2]2+ + 4 H2O
bei hinreichender Ammoniak-Konzentration praktisch vollständig auf der Seite des Amminkomplexes liegt. Kupfer(II) liegt im Komplex in einer stabileren Form vor als unter Standardbedingungen. Im Redoxgleichgewicht
Cu0 + 6 L ⇄ [CuIIL6]2+ + 2 e−
ist hier also die Seite der oxidierten Form stabilisiert (L = Wasser oder Ammoniak), das Gleichgewicht ist zu dieser Seite verschoben. Deutet man die üblichen Standardpotential-Tabellen, die von oben nach unten zunehmend positivere Werte aufführen im Sinne eines zunehmenden Oxidationsvermögens der oxidierten Form, so lässt sich für das Kupfer-Beispiel eine Voraussage treffen. Die oxidierte Form ist im Amminkomplex stabilisiert, damit ist deren Wirkung als Oxidationsmittel, das selbst eine Tendenz hat, reduziert zu werden, vermindert. Das elektrochemische Potential daher sollte in der ammoniakhaltigen Lösung kleiner sein als unter Standardbedingungen, was durch den Messwert von −0.06 V bestätigt wird. Man beachte, dass ähnliche Überlegungen die pH-Abhängigkeit von Redoxpotentialen anschaulich machen. Zink und Aluminium bilden stabile Hydroxidokomplexe, durch welche die jeweils höhere Oxidationsstufe stabilisiert wird. Die Oxidationsneigung der oxidierten Form nimmt also ab, das elektrochemische Potential wird gegenüber dem Potential in saurer Lösung kleiner. Genau dies zeigen die Zahlenwerte, die für die saure Lösung (Al: −1.66, Zn: −0.76 V) höher liegen als für die alkalische (Al: −2.33, Zn: −1.22 V). Praktische Anwendung findet die Verschiebung elektrochemischer Potentiale durch Komplexbildung bei der Cyanidlaugerei, mit deren Hilfe Gold in Lösung gebracht werden kann. Das Oxidationsmittel ist hier Sauerstoff:
2 Au + 4 CN− + ½ O2 + H2O ⇄ 2 [Au(CN)2]− + 2 OH−
Dessen Oxidationskraft (E0 = 1.23 V in saurer Lösung) reicht nicht aus, um elementares Gold zur einwertigen Stufe zu oxidieren (E0 = 1.69 V in saurer Lösung). Cyanidzugabe führt jedoch zur Bildung von stabilem Dicyanidoaurat(I), [Au(CN)2]−. Durch Stabilisierung der oxidierten Form ist das Goldpotential auf +0.60 V erniedrigt, so dass die Reaktion nun möglich ist. Man beachte, dass die anschließende Oxidation von Zink bei der Gold-Freisetzung gemäß
2 [Au(CN)2]− + Zn ⇄ 2 Au + [Zn(CN)4]2−
ebenfalls durch die Bildung eines stabilen Cyanido-Komplexes unterstützt wird. Der industrielle Umgang mit großen Mengen des giftigen Cyanids verlangt natürlich besondere Sorgfalt. Fehlt diese, können die Schäden beträchtlich sein. Man erinnere sich an den katastrophalen Zustand von Theiß und Donau, nachdem am 30. Januar 2000 ca. 100.000 m3 Cyanid-Lauge aus einer rumänischen Laugerei in einen Nebenfluss der Theiß gelangten und über mehrere hundert Kilometer den gesamten Fischbestand in Theiß und Donau auslöschte.
Der Jahn-Teller-verzerrte Aqua-kupfer(II)-Komplex [Cu(H2O)6]2+ hat eine so hohe Bildungstendenz, dass Kupfer(I)-Salze disproportionieren. So setzt sich Kupfer(I)-sulfat mit Wasser nach der folgenden Gleichung um:
Cu2SO4 + 6 H2O → [Cu(H2O)6]2+ + Cu + SO42−
Die Information, dass diese Disproportionierung stattfinden wird, ist in den elektrochemischen Potentialen enthalten. Ein Hilfsmittel, diese und weitere Informationen unmittelbar sichtbar zu machen, sind Volt-Äquivalent-Diagramme, die im englischen Sprachraum meist Frost-Diagramme genannt werden.
Die Abbildung zeigt ein Frost-Diagramm für das Redox-System Cu/CuI/CuII. Die Instabilität gegen Disproportionierung der Oxidationsstufe +I ist unmittelbar ersichtlich. Man leite dazu ab, dass wegen ΔG = −n F E die Disproportionierung freiwillig abläuft, wenn n E größer als der Mittelwert der höheren und der niedrigeren Stufe ist.
Elektrochemische Potentiale, bei deren Formulierung Komplexverbindungen auftreten, sind pH-abhängig, wenn die Liganden protonierbar oder deprotonierbar sind oder wenn Liganden bei Änderung des pH-Wertes substituiert werden. Die Aqua-Liganden hydratisierter Metall-Ionen sind deprotonierbar. Die Folge ist eine elektrostatische Stabilisierung der höheren Oxidationsstufe, das elektrochemische Potential sinkt mit dem pH-Wert, die oxidierende Wirkung der höheren Oxidationsstufe nimmt ab. Quantitativ wird dies durch die Nernstsche Gleichung beschrieben. Diese dient, zusammen mit den Löslichkeitsprodukten eventuell auftretender schwerlöslicher Phasen, zur Konstruktion von Potential-pH-Diagrammen, den sogenannten Pourbaix-Diagrammen.
Zahlenangaben zur Konstruktion des folgenden Diagramms: E0(Fe2+/3+) = 0.77 V; c(Fe) = 1 m. Löslichkeitsprodukte: Fe(OH)3 10−39; Fe(OH)2 10−16:
Eine Veränderung der Gesamtkonzentration der Redoxpartner führt zu charakteristischen Verschiebungen. Bei einem Gesamteisengehalt von 10−6 m ergibt sich das folgende Diagramm:
Bei einer Redox-Reaktion zwischen Komplexen, zum Beispiel bei der Umsetzung
[FeIII(phen)3]3+ + [FeII(CN)6]4− → [FeII(phen)3]2+ + [FeIII(CN)6]3−
muss das übertragene Elektron einen beachtlichen Weg zurücklegen, der beim Zentralmetall des Reduktionsmittels beginnt, durch dessen Ligandsphäre führt, zur Ligandsphäre des Oxidationsmittels springt, diese durchdringt und schließlich beim zweiten Zentralmetall endet. Die Übertragung eines Elektrons durch zwei intakte Ligandsphären hindurch wird „outer-sphere-Mechanismus“ genannt. Sehr viel schneller als dieser läuft das Gegenstück, der „inner-sphere-Mechanismus“ ab, bei dem das Elektron eine weniger lange Strecke zu überwinden hat. Das Charakteristische des inner-sphere-Mechanismus zeigt sich an den Produkten der folgenden Reaktion (H. Taube, 1953):
[Co(NH3)5Cl]2+ + [Cr(H2O)6]2+ + 5 H3O+ → [Co(H2O)6]2+ + [Cr(H2O)5Cl]2+ + 5 NH4+
Man beachte, dass bei der Reaktion zwei inerte und zwei labile Komplexe auftreten. Das Edukt [Co(NH3)5Cl]2+ und das Produkt [Cr(H2O)5Cl]2+ sind inert, die übrigen Komplexe sind labil. Die Bildung des inerten Produktkomplexes mit genau einem Chlorido-Liganden ist bemerkenswert und führte zu der Idee, dass der Chlorido-Ligand des Cobalt-Eduktes über eine definierte Zwischenstufe gezielt auf das Chromatom übertragen wird. Diese Hypothese ließ sich durch ein Markierungsexperiment bestätigen. Wird der Reaktionslösung radioaktives 36Cl− zugefügt, so wird trotzdem nur nichtradioaktiver Chlorido-chrom(III)-Komplex erhalten. Der Produktkomplex enthält also ausschließlich Chlorid, das vor der Reaktion an Cobalt gebunden war. Die Zwischenstufe, welche die Chlor-Übertragung ebenso erklärt wie den durch Verkürzung des Elektronenweges beschleunigten Redoxprozess, enthält offensichtlich das Chloratom als Brückenligand:
[(H3N)5Co–Cl–Cr(H2O)5]4+
Da nach der Elektronenübertragung das Cobaltzentrum labil, das Chrom-Zentralatom aber inert geworden ist, spaltet sich der Cobalt-Teil ab, während das Chromatom seine sechs Liganden – darunter den Chlorido-Ligand – behält.
Voraussetzung für den inner-sphere-Mechanismus ist also ein Ligand, der als Brückenligand auftreten kann, zum Beispiel Halogenido-, Hydroxido-, Cyanido- oder Carboxylato-Liganden, nicht aber Ammin- oder ähnliche Liganden. Dementsprechend verläuft die Oxidation von [Cr(H2O)6]2+ mit [Co(NH3)6]3+ anstelle von [Co(NH3)5Cl]2+ erheblich langsamer nach dem outer-sphere-Mechanismus. Noch unmittelbarer lässt sich die Bedeutung des verbrückten Zweikernkomplexes beim inner-sphere-Mechanismus zeigen, wenn die Reaktanden so gewählt werden, dass nach der Elektronenübertragung beide Metallzentren inert sind. Dann nämlich zerfällt der Zweikernkomplex nicht sofort wieder und kann isoliert werden. Ein Beispiel hierfür ist die Umsetzung von Hexacyanidoferrat(III) mit Pentacyanidocobaltat(II), bei der inerte low-spin-Eisen(II)- und Cobalt(III)-Zentren entstehen:
[FeIII(CN)6]3− + [CoII(CN)5]3− → [(NC)5FeII(CN)CoIII(CN)5]6−
Zum Schluss noch einmal zurück zur ersten Reaktion. Diese bietet eine Gelegenheit, die inzwischen erarbeiteten Konzepte anzuwenden und dadurch die thermodynamischen Randbedingungen verständlich zu machen. Die Reaktion läuft in der angegebenen Richtung freiwillig ab. Dies ist im Einklang mit den elektrochemischen Potentialen. So ist das Potential der Halbzelle [FeII/III(phen)3]2+/3+ 1.12 V, dasjenige der Halbzelle [FeII/III(CN)6]4−/3− 0.36 V. Man vergleiche mit dem Standardpotential in saurer Lösung, also mit Aqua-Liganden statt phen und Cyanid, von 0.77 V. Alle Komplexe mit phen und Cyanid sind low-spin, die Aqua-Komplexe sind high-spin. Wir überlegen, wie das alles zusammenpasst.
Die Bindung eines Carbonylliganden an ein Metall ist umso stabiler, je niedriger die Oxidationsstufe des Metalls ist. Das bisherige Konzept Metall = Lewis-Säure, Ligand = Lewis-Base ist bei Carbonylkomplexen offensichtlich nicht tragfähig. Carbonylliganden weisen vielmehr zugleich eine schwache σ-Donor- und eine π-Akzeptorfähigkeit auf. Eine σ-Hinbindung zum Metall wird durch eine π-Rückbindung vom Metall ergänzt. Dies funktioniert nur mit elektronenreichen Metallzentren. Schlagwörter wie „Metallbase“, „18e-Regel“, „Carbonylhydride“ und „Carbonylmetallate“ beschreiben die recht eigene Chemie dieser Komplexe.
Liganden wie CO und NO+ waren als π-Säuren erkannt worden. Dies hatte für das MO-Schema die Folge, dass (in einem Komplex der Symmetrie Oh) die metallständigen t2g-Orbitale – die bei Abwesenheit von π-Wechselwirkungen zwischen Ligand und Metall nichtbindend sind – bindend werden. Da π-saure Liganden zugleich eine hohe Feldaufspaltung bewirken, ist es günstig, die nun bindenden t2g-Orbitale zu füllen und zugleich die unstabilen eg*-Orbitale nicht zu besetzen. Komplexe dieses Typs erfüllen daher Elektronen-Abzählregeln. Stabile Komplexe sind zu erwarten, wenn neben den sechs Elektronenpaaren aus den Metall-Ligand-σ-Bindungen drei besetzte t2g-Paare hinzukommen. Die Valenzschale des Metalls enthält dann 12 + 6 = 18 Elektronen, was in der ersten Übergangsreihe der Krypton-Konfiguration entspricht.
Carbonyl-Komplexe folgen dieser „18e-Regel“ sehr weitgehend (die Regel wurde hier aus dem MO-Schema eines oktaedrischen Komplexes abgeleitet, sie gilt jedoch unabhängig von der Struktur des Komplexes und kann auch für andere Koordinationszahlen hergeleitet werden). Einkernige Carbonylmetalle sind zum Beispiel das oktaedrische [Cr(CO)6] (d6 + 6 × 2 = 18 e−), das trigonal-bipyramidale [Fe(CO)5] (d8 + 5 × 2 = 18 e−) und das tetraedrische [Ni(CO)4] (d10 + 4 × 2 = 18 e−). Alle drei Komplexe bestehen aus unpolaren Neutralmolekülen, was im Vergleich zu den bisher meist behandelten Komplex-Ionen zu ungewöhnlichen Eigenschaften führt: Während Hexacarbonyl-chrom(0) ein flüchtiger, hydrophober Feststoff ist, sind Pentacarbonyl-eisen(0) und Tetracarbonyl-nickel(0) hydrophobe, wasserklare, farblose Flüssigkeiten.
Es ist lehrreich, diese ungewöhnliche Verbindungsklasse, die überdies den Einstieg in das wichtige Teilgebiet der Organometallchemie vermittelt, schrittweise von den bisher behandelten Komplextypen abzuleiten. Ausgangspunkt kann zum Beispiel das Hexacyanidoferrat(II)-Ion, [FeII(CN)6]4−, sein. Wird der Cyanido-Ligand, CN−, durch den isoelektronischen Carbonyl-Ligand, CO, ersetzt, so wird das Hexacarbonyleisen(II)-Komplexkation, [FeII(CO)6]2+, erhalten.
Dieses, im Gegensatz zu dem zwar oxidationsempfindlichen, aber unter Schutzgas auch bei Anwesenheit von Wasser destillierbaren Fe(CO)5, äußerst zersetzliche Kation kann nur unter Bedingungen synthetisiert werden, bei denen alle üblichen Liganden ausgeschlossen werden – diese würden sonst die Carbonyl-Liganden sofort verdrängen. Dies unterstreicht die große Bedeutung elektrostatischer Anziehung. Auch wenn die Liganden in den beiden Ferraten(III) [FeIIIF6]3− und [FeIII(CN)6]3− zu völlig unterschiedlichen Verhältnissen im Bereich der Grenzorbitale führen – einer high-spin-Situation mit kleinem 10 Dq beim Fluorido-Liganden gegenüber einem low-spin-Komplex mit ungefähr vierfacher Feldaufspaltung beim Anion des roten Blutlaugensalzes – so sind doch beide Komplexe sehr stabil. Die Ursache ist, dass über alle Unterschiede hinaus beide Liganden in erster Linie Anionen sind, die eine starke elektrostatische Anziehung zum Fe3+-Kation aufbauen.
In gleicher Weise wird die Bindung von Neutralliganden wie Ammoniak oder Wasser an ein Zentralmetall-Kation durch deren Dipol-Charakter unterstützt. Kohlenmonoxid dagegen besitzt kein nennenswertes Dipolmoment und ist als Ligand für Eisen(II) ebenso unattraktiv wie das isostere Stickstoffmolekül (man beachte, dass bei CO die negative Formalladung am elektropositiveren Bindungspartner formuliert wird, so dass der formale Dipol durch die Übertragung von Elektronendichte auf das stark elektronegative O+-Zentrum ausgeglichen ist).
Wenig stabile Carbonylkomplexe wie [FeII(CO)6]2+ oder [PdII(CO)4]2+ demonstrieren die entscheidende Bedeutung der Rückbindung vom Metall auf den π-sauren Liganden bei den beständigeren Carbonylkomplexen.
Die VB-Formulierung einer aus Hin- und Rückbindung zusammengesetzten Carbonyl-Metall-Bindung weist anschaulich auf eine experimentelle Möglichkeit hin, die Bindungsverhältnisse zu untersuchen:
M–C≡O
bezeichnet die σ-Hinbindung aus dem HOMO des CO (siehe das MO-Schema des CO weiter oben) in ein leeres Metallorbital vom Typ x2 − y2 oder z2. Ein symmetrie-passendes, doppelt besetztes Metallorbital vom Typ xy, xz, yz überträgt im Sinne einer Rückbindung Ladungsdichte vom Metall in ein CO-LUMO:
M=C=O
Durch die Besetzung antibindender CO-Orbitale sinkt die C-O-Bindungsordnung. Abgeleitete Größen wie die Wellenzahl der C-O-Valenzschwingung zeigen dies deutlich. Je größer die Lewis-Basizität des Metallzentrums ist, umso stärker ist die Rückbindung und umso schwächer ist die C-O-Bindung. Die kleiner werdende Kraftkonstante der C-O-Bindung bei steigender negativer Beladung des Metallzentrums wird besonders klar, wenn das Zentralmetall unverändert bleibt und als Variable dessen Oxidationsstufe – als Maß für die reale Beladung – betrachtet wird:
| C-O-Valenzschwingung/cm−1 | |
|---|---|
| C≡O | 2143 |
| H–C≡O+ | 2184 |
| [Fe(CO)6]2+ | 2204 |
| [Fe(CO)5] | 2034, 2013 |
| [Fe(CO)4]2− | 1790 |
| Me2C=O | 1715 |
Die Tabelle zeigt einen weiteren Effekt auf: obwohl sich aus der VB-Formulierung keine Änderung der C-O-Bindungsstärke durch den Aufbau der σ-Hinbindung ergibt, zeigen die IR-Daten einen merklichen Einfluss, nämlich eine Erhöhung der C-O-Valenzschwingungsfrequenz, bei der Koordination an σ-bindende Lewis-Säuren wie H+. Die Ursachen sind nicht CO-spezifisch, obwohl sie für den Carbonylligand besonders gut untersucht wurden.
Verbindungen wie [Cr(CO)6], [Fe(CO)5] und [Ni(CO)4] gehorchen der 18e-Regel. Ihre typische Chemie – ihre Sauerstoffempfindlichkeit, ihre Reduzierbarkeit zu Carbonylmetallaten oder der nukleophile Angriff auf die Carbonylliganden soll am Beispiel des Pentacarbonyleisen(0) dargestellt werden.
Pentacarbonyleisen(0), [Fe(CO)5], soll detaillierter betrachtet werden, um die Besonderheiten der Carbonylchemie aufzuzeigen.
Die Herstellung von Pentacarbonyleisen(0), bei Raumtemperatur eine farblose Flüssigkeit, gelingt durch die Umsetzung von feinverteiltem Eisen mit Kohlenmonoxid. [Fe(CO)5] ist destillierbar, der Siedepunkt liegt bei ca. 100 °C. Alle Versuche mit Pentacarbonyleisen(0) einschließlich der im folgenden beschriebenen Derivate werden unter striktem Ausschluss von Luftsauerstoff ausgeführt – die ungewöhnlich niedrigen Oxidationsstufen des Zentralmetallatoms garantieren zwar eine starke Bindung der π-aciden Carbonyl-Liganden, sie gehen jedoch mit einer deutlichen Oxidationsempfindlichkeit einher.
Für die Molekülstruktur von Pentacarbonyleisen(0) gibt es zwei sinnvolle Alternativen, entweder die trigonale Bipyramide (Punktgruppe D3h) oder die quadratische Pyramide (Punktgruppe C4v). Im IR-Spektrum werden die beiden oben genannten Valenzschwingungsbanden bei 2034 und 2013 cm−1 beobachtet. Als Übung leiten wir für die beiden denkbaren Molekülstrukturen ab, welche Bandenzahl erwartet werden darf. Der Weg dahin: wir machen uns für die quadratische Pyramide klar, dass die fünf Valenzschwingungsvektoren entsprechend der reduziblen Darstellung Γ 5 1 1 3 1 transformieren; wir benutzen die Reduktionsformel und kommen zu dem Ergebnis, dass die beteiligten Rassen 2A1 + B1 + E sind, machen uns dann klar, dass nur die beiden A1- und die E-Schwingung IR-aktiv sind und erhalten so das Ergebnis, dass drei Banden erwartet werden dürfen. Als Hilfsmittel benutzen wir die Charaktertafel von C4v:
| C4v | E | 2C4 | C2 | 2σv | 2σd | |||
|---|---|---|---|---|---|---|---|---|
| A1 | 1 | 1 | 1 | 1 | 1 | z | x2 + y2, z2 | |
| A2 | 1 | 1 | 1 | −1 | −1 | Rz | ||
| B1 | 1 | −1 | 1 | 1 | −1 | x2 − y2 | ||
| B2 | 1 | −1 | 1 | −1 | 1 | xy | ||
| E | 2 | 0 | −2 | 0 | 0 | (x, y) (Rx, Ry) | (xz, yz) |
Wenn Sie dann das Ganze für D3h genauso machen, ergibt sich, ausgehend von Γ 5 2 1 3 0 3, 2A1′ + E′ + A2′′. IR-aktiv sind E′ + A2′′, also zwei Banden wie auch beobachtet (wie sehen die beiden nichtaktiven A1′-Schwingungen aus?). Als Hilfsmittel auch hier die Charaktertafel:
| D3h | E | 2C3 | 3C2 | σh | 2S3 | 3σv | |||
|---|---|---|---|---|---|---|---|---|---|
| A1′ | 1 | 1 | 1 | 1 | 1 | 1 | x2 + y2, z2 | ||
| A2′ | 1 | 1 | −1 | 1 | 1 | −1 | Rz | ||
| E′ | 2 | −1 | 0 | 2 | −1 | 0 | (x, y) | x2− y2, xy | |
| A1′′ | 1 | 1 | 1 | −1 | −1 | −1 | |||
| A2′′ | 1 | 1 | −1 | −1 | −1 | 1 | z | ||
| E′′ | 2 | −1 | 0 | −2 | 1 | 0 | (Rx, Ry) | (xz, yz) |
Das Ergebnis scheint die trigonale Bipyramide zu sein. Es ist jedoch zu beachten, dass im quadratisch-pyramidalen Fall zwei der drei Banden zufällig zusammenfallen könnten. Man würde daher für beide Strukturen die Lage der Valenzschwingungen berechnen, um sicher zu gehen. Für den festen Zustand ist der trigonal-bipyramidale Molekülbau durch Einkristallstrukturanalyse gesichert:
Zu den typischen und für einen Werner-Komplex kaum denkbaren Eigenschaften von Pentacarbonyleisen(0) gehört die Hiebersche Basenreaktion, die mit dem Angriff eines Nukleophils auf ein Pentacarbonyleisen-Molekül beginnt.
Das Reagenz ist das Hydroxid-Ion. Bei einem Eisen(II)- oder Eisen(III)-Komplex vom Werner-Typ würde die Lewis-Base OH− am Lewis-aciden Zentralatom angreifen – es wäre zum Beispiel zum Ligandenaustasch gekommen. Das Zentralatom im Pentacarbonyleisen(0) dagegen ist nicht Lewis-acide. Es sind vielmehr die Carbonyl-Liganden, die aufgrund ihrer unbesetzten π*-Orbitale mit Elektronenpaardonatoren wechselwirken können, sei es im Sinne einer Rückbindung vom Metall oder als Ziel eines nukleophilen Angriffs, hier durch ein Hydroxid-Ion. Dabei entsteht ein unbeständiger Hydroxycarbonyl-Komplex, der nach dem Muster einer β-H-Eliminierung in das Tetracarbonyl-hydridoferrat(0)-Ion übergeht (in den folgenden Schemata symbolisiert ein Bindungsstrich einen CO-Liganden).
Das Tetracarbonyl-hydrido-ferrat(0) ist noch deutlicher als Pentacarbonyleisen(0) eine Metallbase. Protonierung führt zum Tetracarbonyl-dihydrido-eisen(II), indem das eintretende Proton an das Eisenzentralatom gebunden wird. (Jetzt häufen sich die Probleme: das Proton bindet also an die Position weicher Basizität, nicht an eines der vier Carbonylsauerstoffatome; können Sie diesen Verstoß gegen das HSAB-Prinzip erläutern? Schlimmer noch: aus einer Brønsted-Säure-Base-Reaktion geht das Eisenatom um zwei Einheiten oxidiert hervor, eine oxidative Addition hat stattgefunden. Wieso?). Eine weitere Deprotonierung zum Tetracarbonylferrat(−II) scheitert in wässriger Lösung an der zu geringen Acidität des Hydridoferrats (warum aber kommt es nicht zu einer erneuten Hieberschen Basenreaktion, es gibt schließlich noch vier Carbonylliganden?). Salze des [Fe(CO)4]2−-Ions (das Dioxanaddukt an das Natriumsalz ist „Collmans Reagenz“) sind jedoch aus aprotischer Lösung durch Reduktion von Pentacarbonyleisen(0) zugänglich:
Die weiche Metallbasizität von Carbonylferraten wird besonders bei deren Reaktion mit weichen Lewis-Säuren unter Bildung weitgehend kovalenter Bindungen deutlich. Ist die Lewis-Säure ein Metall-Ion, werden Metall-Metall-Bindungen geknüpft. Sind dabei die Bausteine zweibindig, entstehen Ringe oder Ketten:
Ein Fischer-Carben-Komplex wird erhalten, wenn in einem ersten Schritt anstelle des Hydroxids der Hieberschen Basenreaktion ein Metallalkyl eingesetzt wird. Es entsteht ein Acyl-Komplex, der in einer anschließenden Reaktion mit einem Elektrophil umgesetzt werden kann. Das R'+-Elektrophil im folgenden Schema stammt in der Praxis zum Beispiel aus Trialkyloxonium-Salzen.
Ein Fischer-Carben-Komplex ist durch einen elektrophilen Carben-Liganden charakterisiert, der, ähnlich wie CO, eine Rückbindung akzeptiert und durch Nukleophile angreifbar ist. Carben-Liganden dieses Typs liegen in freier Form im Singulett-Grundzustand vor, was ihre Ähnlichkeit zu CO (dem „Oxocarben“) weiter unterstreicht:
Carbonylmetall-Fragmente, die aufgrund einer ungeraden Elektronenzahl des Metalls nicht die 18e-Regel erfüllen können, bilden in der Regel keine beständigen einkernigen Carbonylkomplexe. Beispiele sind die reaktiven 17-e-Fragmente Co(CO)4 und Mn(CO)5, die ihr Elektronendefizit in charakteristischer Weise auszugleichen versuchen. Das folgende Bild zeigt das Ergebnis einer Rechnung an Mn(CO)5, die als Struktur eine quadratische Pyramide ergibt. Die Symmetrie ist C4v, die vier basalen Carbonylgruppen bilden einen annähernd rechten Winkel mit der axialen Carbonylgruppe (Cax-Mn-C = 96.6° auf bp/tzvp-Niveau). Das spintragende Orbital verläuft entlang der C4-Achse. Dargestellt ist das kanonische MO; VB-artige Methoden würden ein ähnliches Orbital an Mangan lokalisieren.
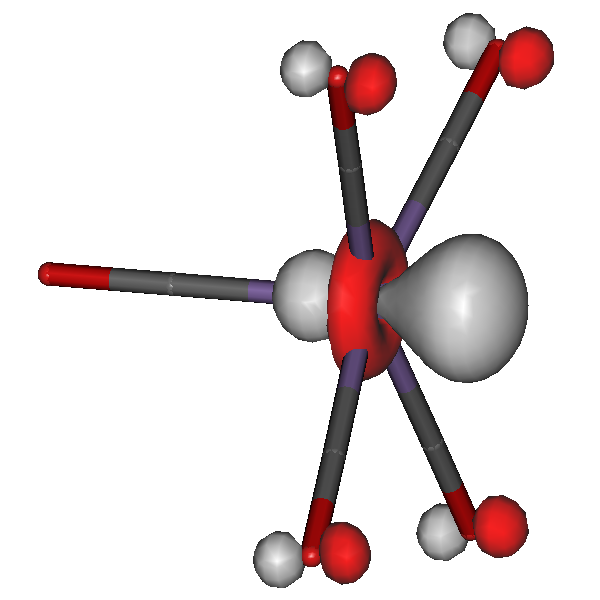
Das Ergebnis, dass das spintragende Orbital im wesentlichen d(z2)-Charakter hat und daher zur Ausbildung von σ-Bindungen zur Verfügung steht, lässt sich mit dem Kristallfeldmodell plausibel machen. Vom Oktaeder ausgehend, führt die Entfernung eines Liganden entlang z zur Stabilisierung der z-haltigen Orbitale. Mit steigender Energie ergibt sich die Orbitalreihenfolge (xz, yz), xy, z2, x2−y2. Das Einfüllen von sieben Elektronen in low-spin-Verteilung ergibt dann (xz, yz)2, (xy)2, (z2)1, (x2−y2)0.
Das Pentacarbonylmangan-Fragment ist aufgrund dieser Orbitalsituation isolobal zum Beispiel mit einem Halogenatom oder einer Methylgruppe, aber auch mit den näher verwandten 17-e-Fragmenten wie dem Tetracarbonylcobalt(0). Werden Parameter wie die Orbitalenergie oder die (Gruppen-)Elektronegativität hinzugenommen, ergibt sich eine besondere Ähnlichkeit der Carbonylmetallfragmente mit einem Iod-Atom. Die sich hieraus ergebenden Analogien sind weitreichend. So dimerisiert der 17e-Pentacarbonylmangan-Rest wie ein Halogenatom zum Dekacarbonyldimangan mit einer Mn-Mn-Einfachbindung:
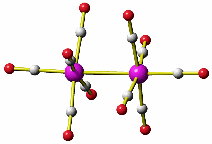
In Analogie zu einer Interhalogen-Verbindung wie IBr existiert ein [Mn(CO)5Br] mit Mn-Br-Bindung:
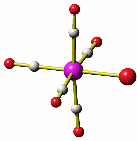
Weitreichende Analogien zwischen Carbonylmetall-Fragmenten und Halogenatomen findet man auch bei Cobalt. Analog zu I2 mit der typischen Disproportionierung in Base und seiner Reduzierbarkeit verhält sich Octacarbonyldicobalt(0): das zu I− analoge [Co(CO)4]− existiert und fällt ein lichtempfindliches gelbes Silbersalz, [CoH(CO)4] ist eine starke Säure, [Co(CO)4–Hg–Co(CO)4] ist ein linear aufgebautes Molekül, etc. Die Molekülstruktur des Octaacarbonyldicobalts im Kristall weist dabei als Besonderheit neben einer formalen Co-Co-Bindung zwei verbrückende Carbonylliganden auf, wodurch die Elektronenbilanz nicht verändert wird:
Methanol kann Rh/I-katalysiert zu Essigsäure carbonyliert werden. Bei den Einzelschritten der Katalyse finden sich einige der hier besprochenen Konzepte wieder. Der Cyclus lässt sich in Einzelschritte zerlegen, die sich in zahlreichen weiteren Katalysecyclen und in stöchiometrischen Reaktionen der Organometallchemie wiederfinden. Das folgende Schema (auch als pdf) zeigt, dass der eigentliche metallkatalysierte Cyclus mit einem weiteren Cyclus vernetzt ist, bei dem Methanol und Iodwasserstoff zu Iodmethan und Wasser reagieren; später dann wird Acetyliodid zu Essigsäure und Iodwasserstoff hydrolysiert:
Der hervorgehobene Cyclus beginnt mit einem Komplex, dessen Aufbau den weiter oben genannten Regeln folgt: Im Dicarbonyl-diiodido-rhodat(I) ergibt sich für das Metall eine d8-Konfiguration, der Komplex ist daher quadratisch-planar. Die Gesamtelektronenzahl ist 16. Dieser 16-Elektronen-d8-Fall ist die wichtigste Ausnahme von der 18-Elektronen-Regel in Komplexen mit großer Feldaufspaltung. Ist die Elektronendichte am Metall hinreichend groß, so vermittelt das Elektronenpaar im stabilisierten dz2-Orbital dem Komplex Metallbasizität. In diesem Fall kann das Metall als Nukleophil an ein elektrophiles Substrat angreifen. Man beachte die Analogie zwischen dem ersten Reaktionsschritt und der oben beschriebenen Protonierung eines Carbonylmetallats:
Der erste Schritt im Katalysecyclus ist eine oxidative Addition an ein polares Substrat. Ausgehend von einem 16-Elektronen-Komplex führt dieser Schritt zu einer koordinativ ungesättigten Spezies, so dass in der Regel trans zum vormaligen Elektrophil dessen Abgangsgruppe als sechster Ligand gebunden wird. Da der mechanistische Ablauf einer nukleophilen Substitution am polaren Edukt mit einer Metallbase als Nukleophil entspricht, ist die Nukleophilie des Metallzentrums eine kritische Variable. Dies gilt vor allem im Monsanto-Prozess, in dem Schritt a der geschwindigkeitsbestimmende Schritt ist. Hilfsliganden, welche die Nukleophilie des Metallzentrums herabsetzen, führen zu vermindertem Umsatz. So sind die leichten Homologen [Rh(CO)2X2]− mit X = Cl oder Br keine geeigneten Katalysatoren für die Methanol-Carbonylierung.
Teilschritt b wird meist als Angriff eines metallgebundenen Nucleophils an eine elektrophile Position eines cis-ständigen Nachbar-Liganden verstanden. Man beachte die Beziehung zur Hieberschen Basenreaktion und vor allem zur Synthese von Fischer-Carbenen: dort griff ein externes Nukleophil einen Carbonylliganden an, hier ist es ein metallgebundenes. Im Monsanto-Verfahren führt der Angriff eines formalen CH3−-Fragments an das C-Atom einer Carbonylgruppe zu einem Acetyl-Ligand – so wie bei der Fischer-Carben-Synthese, wenn für den ersten Schritt ein Metallmethyl eingesetzt wird.
Nicht für jeden formal anionischen Liganden X− liegt das Gleichgewicht b so weit auf der Seite des neu gebildeten CXO-Liganden, dass das anschließende Wiederauffüllen der Koordinationslücke am Zentralmetall den Fortgang des Cyclus sichert. So wurde die Ablösung eines Hydrido-Liganden unter Bildung eines Formyl-Liganden – also die Folge b/c mit H anstelle von CH3 – bisher noch nicht beobachtet (wie würden Sie deshalb einen Formyl-Komplex synthetisieren?). Dasselbe gilt für den nucleophilen Angriff eines Acyl- auf einen Carbonyl-Liganden, was bei fortgesetzter CO-Insertion zu polymerem CO führen würde.
Schritt b ist im Monsanto-Verfahren ein gut untersuchtes Gleichgewicht mit ungewöhnlich großem Anteil an Insertionsprodukt. Im verwandten, neu entwickelten „Cativa“-Prozess, bei dem der homologe, stärker nucleophile Iridiumkomplex [Ir(CO)2I2]− als Katalysator eingesetzt wird, ist die Methylwanderung und nicht mehr die oxidative Addition der geschwindigkeitsbestimmende Schritt.
Die Möglichkeit, das Produkt von Schritt b spektroskopisch und strukturanalytisch zu untersuchen, ist nicht alltäglich. Oft ist die koordinativ ungesättigte Form nur in sehr geringer Menge im gleichgewicht vorhanden und es kommt sofort zur Auffüllung der Koordinationslücke, die hier mit CO erfolgt. Aufgrund dieser zusammenhängenden Reaktionsfolge wurde von „CO-Insertion“ gesprochen, da es den Anschein hatte, als wäre das von außen hinzukommende CO-Molekül das inserierte. Es wurde jedoch gezeigt (wie könnte man das tun?), dass die Alkylgruppe auf eine bereits metall-gebundene CO-Gruppe wandert.
Der Katalysecyclus schließt mit einer reduktiven Eliminierung. Die Oxidationzahl des Rhodiums sinkt wieder um 2 Einheiten, wodurch das Metallzentrum wieder in eine oxidierbare Form überführt wird.